
【题目】一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右(假使甲烷完全分解),然后恢复至室温(20℃)。这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍。下列判断正确的是( )
A.m=2,n=0.25B.m=0.5,n=4C.m=2,n=4D.m=0.5,n=0.25
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型图,图中的“棍”代表单键或双键,不同大小的“球”代表不同的短周期元素的原子,对该有机物的叙述不正确的是
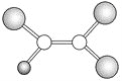
A. 该有机物可能的化学式为C2HCl3
B. 该有机物可以由乙烯和氯化氢通过加成反应得到
C. 该有机物分子中的所有原子在一个平面上
D. 该有机物分子中一定有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
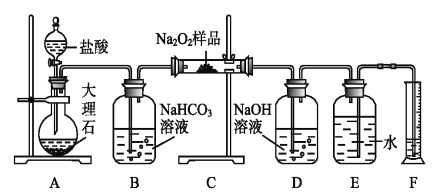
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________________;
(2)写出与H2O分子互为等电子体的微粒_________________________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________
A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
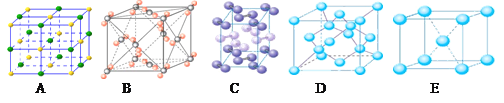
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]、硫氰[(SCN)2]等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2===2Fe(SCN)3、Ag++CN-===AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2=2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (OCN)2+H2O =2H++OCN-+OCNO-
D. MnO2+4HSCN![]() (SCN)2+Mn(SCN)2+2H2O
(SCN)2+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
选项 | 目的 | 古代文献 | 说明 |
A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,则祸不可测”——《天工开物》 | KNO3能自燃 |
B | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4);“强烧之,紫青烟起,云是硝石也”——《本草经集注》 | 利用焰色反应 |
C | 提纯 | “(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》 | 溶解,蒸发结晶 |
D | 性质 | “(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”——《本草纲目》 | 利用KNO3的氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系是,使用类似数组的方法可以收到的直观形象的效果,下列表达不正确的是 ( )
A.分散质粒子直径与分散系种类:![]()
B.NaOH溶液与CO2反应后溶液中的钠盐: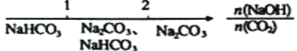
C.Na与O2反应的产物: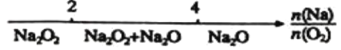
D.A1C13溶液中滴加Na0H溶液后铝的存在形式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中含有大量SO2和NO。某科研小组研究臭氧氧化-碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
NO2(g)+O2(g) △H1=-200.9kJ/mol Ea1=3.2kJ/mol
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
SO3(g)+O2(g) △H2=-241.6kJ/mol Ea2=58kJ/mol
已知该体系中温度80℃以上臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
(1)已知反应Ⅰ在低温下自发进行,则该反应的熵变△S___0(填“大于”或“小于”)。
(2)其它条件不变,每次向反应器中充入含1.0molNO、1molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因___。
②100℃、反应相同时间t时O3的分解率达10%,则体系中剩余O3的物质的量是___mol。
③下列法正确的是___。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
(3)工业上可以通过电解NO制备NH4NO3,原理如图所示。写出电解过程阳极的电极反应式___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则A的分子式可能为____,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式为______;
(2)已知1mol烃B中所含电子总数为42NA,且C、H两种元素的质量比为5:1,则其分子式为______,它有_____种同分异构体,在它的同分异构体中,沸点最高的是______(写结构简式);一氯代物只有一种的是_____(写习惯名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com