
| A. | CuSO4 | B. | CaCl2 | C. | Na2SO4 | D. | Ca(ClO)2 |
科目:高中化学 来源: 题型:解答题

| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-38 | 2.2×10-20 | 5.48×10-18 | 3.2×1018 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

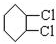 ,C
,C
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| I1 | I2 | I3 | I4 | … |
| 783 | 1451 | 7733 | 10540 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与过量的铁反应,转移2NA个电子 | |
| B. | 1mol ${\;}_{92}^{235}$U核素含有235NA个中子 | |
| C. | 1mol N2与3mol H2混合充分反应,转移的电子数目为6NA | |
| D. | 常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 写出MnO2与浓盐酸反应制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.已知KMnO4与浓盐酸在常温下反应也可制得Cl2,某同学利用该原理,用图所示的装置制备纯净、干燥的氯气,并做氯气与金属反应的实验.每个虚线框表示一个单元装置,其中有错误的是哪几处?②③④(填序号)
写出MnO2与浓盐酸反应制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.已知KMnO4与浓盐酸在常温下反应也可制得Cl2,某同学利用该原理,用图所示的装置制备纯净、干燥的氯气,并做氯气与金属反应的实验.每个虚线框表示一个单元装置,其中有错误的是哪几处?②③④(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑤ | C. | ①③ | D. | ①④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com