
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列有关该电池说法不正确的是
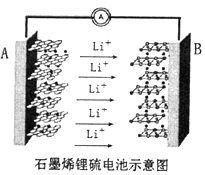
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-=Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于普通玻璃的叙述中,正确的是( )
A. 它是人类最早使用的硅酸盐材料
B. 红色玻璃中含氧化亚铜
C. 它在加热熔化时有固定的熔点
D. 无色玻璃是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
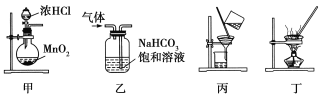
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为____________ mol·L-1·min-1。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为甲:v(X)=3.5 mol·L-1·min-1;乙:v(Y)=2 mol·L-1·min-1;丙:v(Z)=4.5 mol·L-1·min-1;丁:v(X)=0.075 mol·L-1·s-1。若其他条件相同,温度不同,则温度由高到低的顺序是(填序号)______ ______。
(3)若向达到(1)的平衡体系中充入氦气,则平衡__________(填“向左”、“向右”或“不”)移动;若从达到(1)的平衡体系中移走部分Y气体,则平衡____________(填“向左”、“向右”或“不”)移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较( )
A.无法确定 B.前者一定大于后者
C.前者一定等于后者 D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则:a、b、c应该满足的关系为___________________。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
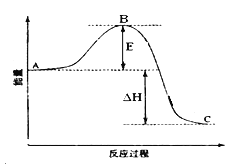
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”)。
(2)图中△H= kJ·mol-1;
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.2Na+2H2O===2NaOH+H2↑是酸碱反应
B.ClO-+H2O===HClO+OH-是酸碱反应
C.碱性强弱顺序:ClO->OH->CH3COO-
D.HCO![]() 既是酸又是碱,NH3既不是酸又不是碱
既是酸又是碱,NH3既不是酸又不是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示0.1LpH=2的HC1溶液加水稀释至VL, pH随lgV的变化
C. 图丙表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1
D. 图丁表示同一温度下,再不同容积的容器中进行反应2BaO2(s)![]() 2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com