
| A. | 1 种 | B. | 2 种 | C. | 4 种 | D. | 5 种 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的 pH 逐渐增大 | B. | 溶液中的 c(OH-)逐渐减小 | ||
| C. | 醋酸的电离程度逐渐增大 | D. | 溶液的导电能力逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr 与 AgNO3 溶液反应会生成浅黄色沉淀 | |
| B. | IBr 与水反应属于氧化还原反应,IBr 既作氧化剂又作还原剂 | |
| C. | IBr 属于共价化合物 | |
| D. | 反应 IBr+2Na=NaBr+NaI 中,每反应 2mol Na,电子转移数目为 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯都可以使溴水褪色 | |
| B. | 乙醇和乙酸都存在碳氧双键 | |
| C. | 高锰酸钾酸性溶液不可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通肥皂的主要成分是高级脂肪酸钠盐 | |
| B. | 利用氢化反应将液态植物油转变为固态反式脂肪酸的过程发生的是还原反应 | |
| C. | “皮革奶粉”含有大量有毒物质,不能食用 | |
| D. | 沾有血迹的衣物要用热水和加酶洗衣粉浸泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | 分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同 | |
| C. | 向50 mL 18 mol•L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
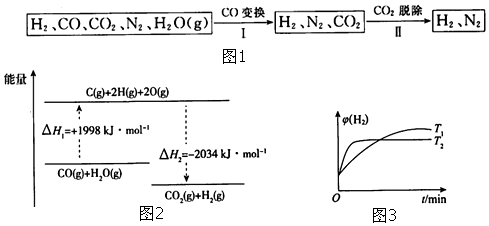
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com