
 、④HCHO等,其中碳原子不是采取sp2杂化的分子有②(填物质编号),HCHO分子的立体构型为平面三角形.
、④HCHO等,其中碳原子不是采取sp2杂化的分子有②(填物质编号),HCHO分子的立体构型为平面三角形. 分析 Ni的基态原子核外电子排布式为1s22s22p63s23p63d84s2,同一能级轨道上的电子能量相同;CH2=CH2、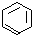 、HCHO中碳原子均形成3个σ键、没有孤对电子,杂化轨道数目为3,而HC≡CH中碳原子均形成2个σ键、没有孤对电子,杂化轨道数目为2.
、HCHO中碳原子均形成3个σ键、没有孤对电子,杂化轨道数目为3,而HC≡CH中碳原子均形成2个σ键、没有孤对电子,杂化轨道数目为2.
解答 解:Ni的基态原子核外电子排布式为1s22s22p63s23p63d84s2,同一能级轨道上的电子能量相同,则原子有7种能量不同的电子;CH2=CH2、 、HCHO中碳原子均形成3个σ键、没有孤对电子,杂化轨道数目为3,碳原子采取sp2杂化,HCHO的空间构型为平面三角形,而HC≡CH中碳原子均形成2个σ键、没有孤对电子,杂化轨道数目为2,碳原子采取sp杂化,
、HCHO中碳原子均形成3个σ键、没有孤对电子,杂化轨道数目为3,碳原子采取sp2杂化,HCHO的空间构型为平面三角形,而HC≡CH中碳原子均形成2个σ键、没有孤对电子,杂化轨道数目为2,碳原子采取sp杂化,
故答案为:7;②;平面三角形.
点评 本题考查核外电子排布规律、杂化方式与空间构型判断,注意对基本概念的理解,题目难度适中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
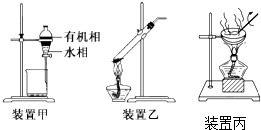
| A. | 用玻璃棒蘸取CH3COOH溶液点在水湿润的pH试纸上,测定该溶液的pH | |
| B. | 用装置甲分液,放出水相后再从分液漏斗上口放出有机相 | |
| C. | 用装置乙加热分解NaHCO3固体 | |
| D. | 用装置丙加热硫酸铜溶液获得CuSO45H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 完全氧化56gFe需要消耗氯气33.6 L | |
| B. | 某浓度氢氧化钠溶液恰好溶解5.4g的铝,则被还原的水的分子数为0.6NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9 NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com