
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
| △c |
| △t |
| 1 |
| 2 |
| 3 |
| 2 |
| 高温高压 |
| 催化剂 |
| △C |
| △t |
| 3mol∕L |
| 2min |
| C2(NH3) |
| C( N2 )C3(H2) |
| 22 |
| 1×33 |
| 4 |
| 27 |
| 4 |
| 27 |


科目:高中化学 来源:2010-2011学年北京市东城区高三第一学期期末考试化学试卷 题型:填空题
氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
|
温度/°C |
200 |
300 |
400 |
500 |
600 |
|
氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是 。
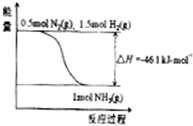
(2)根据-4,合成氨的热化学方程式是 。

(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
N2+3H2
 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=
;该温度下的平衡常数K=
(用分数表示);俗使K增大,可以采取的措施是
。
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=
;该温度下的平衡常数K=
(用分数表示);俗使K增大,可以采取的措施是
。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是 (选填序号字母)
a.及时分离出NH3 b.升高温度
c.增大压强 d.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2012届北京市高二下期3月份月考化学试卷 题型:填空题
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下表.请回答:
|
温度/℃ |
200 |
300 |
400 |
500 |
600 |
|
氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是______________________________________.
(2)在一定温度下,将2molN2和6 molH2通入到体积为1 L的密闭容器中,发生反应N2+ 3H2 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=_________;该温度下的平衡常数K=___________(用分数表示);欲使K增大,可以采取的措施是_______.
2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=_________;该温度下的平衡常数K=___________(用分数表示);欲使K增大,可以采取的措施是_______.
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是____(选填序号字母);从化学反应速率的角度分析,提高反应速率可采取的措施是_____(选填序号字母).
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:填空题


 2NH3,
2NH3,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com