
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氧化物的方法来制备其单质 |
| C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应 |
| D.从海水中提取溴单质的过程所涉及的反应均为置换反应 |
 Al2O3+3H2O,没有元素的化合价变化,也不属于氧化还原反应,C正确。
Al2O3+3H2O,没有元素的化合价变化,也不属于氧化还原反应,C正确。

 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 冶炼原理 | 方法 |
| A | 2HgO 2Hg+O2↑ 2Hg+O2↑ | 热分解法 |
| B | 2Al2O3(熔融) 4Al+3O2↑ 4Al+3O2↑ | 电解法 |
| C | Cu2S+O2 2Cu+SO2 2Cu+SO2 | 热分解法 |
| D | Fe2O3+2Al 2Fe+Al2O3 2Fe+Al2O3 | 热还原法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从海带中提取碘单质的过程涉及氧化还原反应 |
| B.往淡水中加入氯化钠等配成人造海水,可用于海产品的长途运输 |
| C.赤潮主要是工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D.以海水为原料制取镁的过程未发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
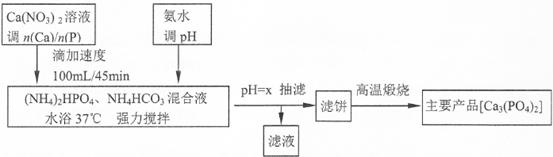

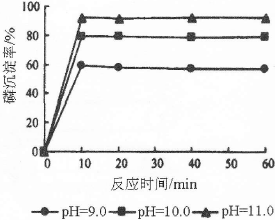
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
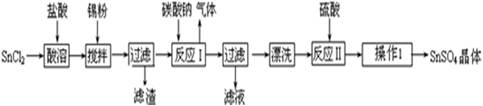

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2AlCl3(熔融)  2Al+3Cl2↑ 2Al+3Cl2↑ |
B.MgO+H2 Mg+H2O Mg+H2O |
C.ZnO+CO  Zn+CO2 Zn+CO2 |
D.2CuO  2Cu+O2↑ 2Cu+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
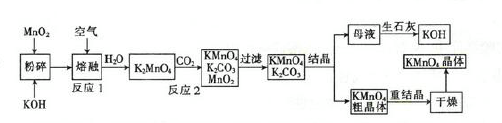
| A.75%酒精 | B.O3 | C.二氧化硫 | D.漂白粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.海水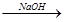 Mg(OH)2 Mg(OH)2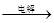 Mg Mg |
B.海水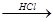 MgCl2溶液 MgCl2溶液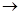 MgCl2熔融 MgCl2熔融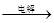 Mg Mg |
C.海水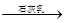 Mg(OH)2 Mg(OH)2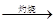 MgO MgO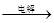 Mg Mg |
D.海水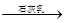 Mg(OH)2 Mg(OH)2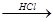 MgCl2溶液 MgCl2溶液 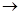 MgCl2熔融 MgCl2熔融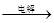 Mg Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com