
| A.AgCl=AgI=Ag2S | B.AgCl<AgI<Ag2S |
| C.AgCl>AgI>Ag2S | D.AgI>AgCl>Ag2S |
科目:高中化学 来源:不详 题型:实验题
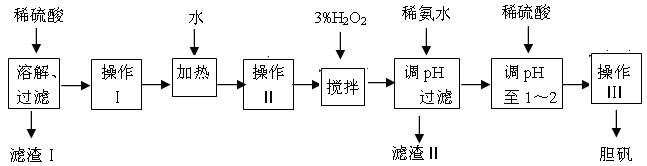
| | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCO3-+OH-,下列说法正确的是( )
HCO3-+OH-,下列说法正确的是( ) | A.稀释溶液,水解平衡常数增大 |
| B.加入NaOH固体,c(HCO3-)/c(CO32-) 减少 |
| C.升高温度,平衡常数减小 |
| D.通入CO2,pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
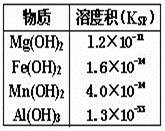
| A.Al3+最先转化为Al(OH)3沉淀 |
| B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀 |
| C.要使Mg2+转化为沉淀,溶液pH应大于9 |
| D.pH=14时,四种金属离子全部以沉淀形式存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数 |
C.25oC时Ksp(AgCl)=l.8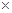 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI |
| D.温度一定时,当溶液中Ag+和Cl-物质的量浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.①④③②⑤ | C.⑤④①②③ | D.④③⑤②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com