
| A、反应液使红色石蕊试纸变蓝 |
| B、反应后静置,反应液不分层 |
| C、反应后静置,反应液分为两层 |
| D、反应液使蓝色石蕊试纸变红 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
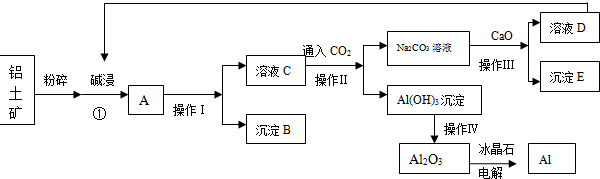
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO2(mol) | 0.05 | 0.15 | 0.6 |
| NaX(mol) | |||
| Na2CO3(mol) | |||
| NaHCO3(mol) |
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
A、由-CH3、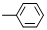 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 | ||
B、某种兴奋剂的结构简式如图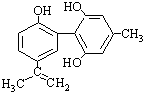 ,1mol该物质与浓溴水反应时最多消耗Br2为6mol ,1mol该物质与浓溴水反应时最多消耗Br2为6mol | ||
C、有机物X、Y、M的转化关系为:淀粉→X→Y
| ||
D、高分子化合物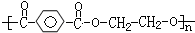 ,其链节为对苯二甲酸和乙二醇 ,其链节为对苯二甲酸和乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | C-B | C=B | |
| 键能:/kJ?mol-1 | 360 | 803 | 464 | 640 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.000 84 | 0.01 |
| A、已知MgCO3的Ksp=6.82×10-6 mol2?L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 mol2?L-2 |
| B、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| C、将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com