
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
分析 A.反应②为放热反应,放热反应中反应物所具有的总能量大于生成物所具有的总能量;
B.气态水具有能量较高,则该反应放出热量大于反应②;
C.反应②中生成1mol氮气消耗1mol氧气,转移了4mol电子,据此计算转移0.16mole-生成氮气的量;
D.用惰性电极电解硫酸钠溶液时,实质为水解水.
解答 解:A.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol,该反应的焓变为负值,为放热反应,则反应物所具有的总能量大于生成物所具有的总能量,故A正确;
B.根据N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol可知:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ/mol,液态水具有能量较低,则2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H<-1135.7 kJ/mol,故B错误;
C.反应②中转移0.16mole-生成氮气的物质的量为:1mol×$\frac{0.16mol}{4mol}$=0.04mol,生成氮气的质量为:28g/mol×0.04mol=1.12g,故C错误;
D.铂作电极、Na2SO4作电解质溶液,由反应②设计的燃料电池,电解实质为电解水,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变,仍然为7,故D正确;
故选AD.
点评 本题考查了反应热与焓变的应用,题目难度中等,涉及氧化还原反应的计算、反应热与焓变的应用、电解原理等知识,明确化学反应与能量变化之间的为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
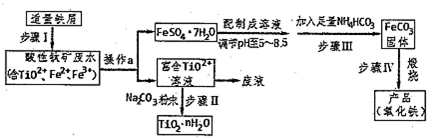
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
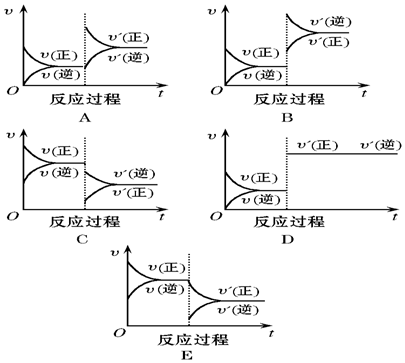
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
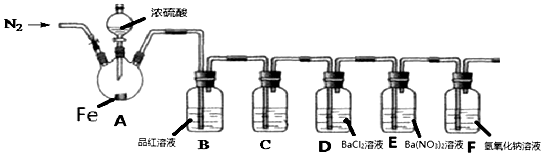
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
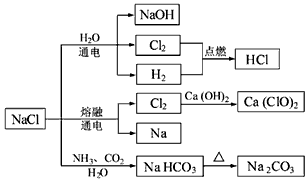
| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3 gNa+中含有NA个电子 | |
| B. | 硫酸的摩尔质量与硫酸分子的质量相等 | |
| C. | NA个CC14分子在标准状况下的体积约为22.4 L | |
| D. | 18 g H2O中含有NA个H2、NA个O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
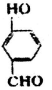 比
比 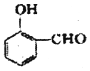 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com