



 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:不详 题型:单选题
| A.加快碘元素与水反应的速率 | B.使溶液浓缩 |
| C.使空气中的氧气更多地进入溶液 | D.加速碘化物的溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
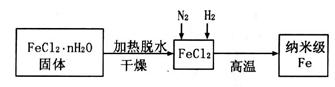
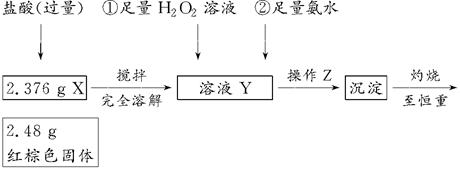
 固体加热脱水通常要通入 。
固体加热脱水通常要通入 。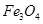 。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。
。甲同学用下图所示装置进行纳米级Fe粉与水蒸气的反应并验证固体产物。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入稀盐酸产生无色气体,一定含有CO32ˉ |
| B.加入氯化钡溶液产生白色沉淀,一定含有SO42ˉ |
| C.加入碳酸钠溶液产生白色沉淀,一定含有Ca2+ |
| D.取溶液进行焰色反应显黄色,一定含有Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 向NaOH溶液中滴加FeCl3饱和溶液 | 制备Fe(OH)3胶体 |
| B | 向AgCl和水的混合物中滴加KI溶液,产生黄色沉淀 | 验证溶解度AgI小于AgCl |
| C | 淀粉溶液和稀硫酸混合加热后,加新制的Cu(OH)2悬浊液加热至沸腾 | 检验淀粉水解是否完全 |
| D | 将乙醇与浓硫酸共热,制得的气体通入酸性高锰酸钾溶液中 | 检验气体中有乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

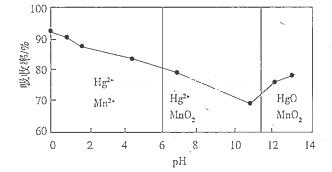
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
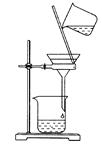
| A.分离乙醇和乙酸乙酯的混合物,所用玻璃仪器为分液漏斗、烧杯 |
B.用如图所示装置分离CCl4萃取碘水后已分层的有机层和水层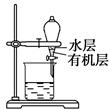 |
| C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| D.用如图所示装置除去乙醇中的苯酚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com