
| A. | 少量SO2通入过量氨水中:NH3•H2O+SO2→HSO3-+NH4+ | |
| B. | H2S通入氯水中:S2-+Cl2→S↓+2Cl- | |
| C. | 二氧化氮溶于水:3NO2+H2O→2H++2NO3-+NO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O |
分析 A.二氧化硫少量,反应生成亚硫酸根离子;
B.硫化氢为气体,离子方程式中不能拆开;
C.二氧化氮与水反应生成硝酸和NO;
D.硫酸氢钠少量,离子方程式按照硫酸氢钠的化学式组成书写.
解答 解:A.少量SO2通入过量氨水中,反应生成亚硫酸铵和水,正确的离子方程式为:2NH3•H2O+SO2=SO32-+2NH4++2H2O,故A错误;
B.H2S通入氯水中,二者发生氧化还原反应,硫化氢不能拆开,正确的离子方程式为:H2S+Cl2=2H++S↓+2Cl-,故B错误;
C.二氧化氮溶于水的离子方程式为:3NO2+H2O=2H++2NO3-+NO,故C正确;
D.少量NaHSO4与过量Ba(OH)2溶液反应,反应生成氢氧化钠、硫酸钡和水,正确的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故D错误;
故选C.
点评 本题考查离子方程式的书写判断,题目难度不大,明确发生反应实质为解答关键,注意掌握离子方程式的书写原则,试题有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | K(HF)=c(F-)?c(H+)/c(HF ) | B. | K(HNO2)=7.2×10-4 | ||
| C. | 酸性强弱为 HF>HNO2 | D. | K(HNO2)<K(HF) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:
我国规定:室内甲醛含量不得超过0.08mg•m-3.某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你协助他们完成相关学习任务.(部分装置如图),其反应原理及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag得到电子 | B. | X为AgS | ||
| C. | O2被还原 | D. | 每生成1 mo1X转移电子数4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
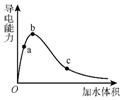 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
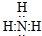 ,氯化铵
,氯化铵 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的简单离子是其所在周期中元素的简单离子半径最小的 | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Y与W形成的化合物一定能使酸性高锰酸钾溶液腿色 | |
| D. | 最高价氧化物对应水化物的酸性X比W的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com