
���� ��1����Ӧ��ֱ��ں��º��������к;��Ⱥ��������н��У����߾��ﵽƽ������������¶�����ƽ��������У�������̼Ũ��������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
��2��0-t1ʱ���ڸû�ѧ��Ӧ����v��CO2��=$\frac{��c}{��t}$����ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȼ��㰱���ķ�Ӧ���ʣ�ͼ�����������̼��ƽ��Ũ��Ϊ0.025mol/L�������Сһ��Ũ������һ��ӦΪ0.05mol/L���淴Ӧ���дﵽƽ��״̬����Ϊ������Ϊ���壬���ﵽ��ͬƽ��״̬��������̼Ũ�Ȳ��䣬�ݴ˻����仯���ߣ�
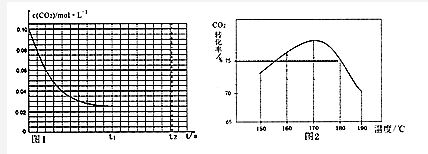
��3��ͼ��任������֪����ʼ������̼ת��������170��C������¶����ߣ�������̼ת���ʼ�С����Ӧ�Ƿ��ȷ�Ӧ��˵��ƽ��������еĽ����˵��170��Cǰ��ӦΪ�ﵽƽ��״̬��180��C������̼ת����Ϊ75%����ϻ�ѧƽ�����м�����ʽ����õ�ƽ��Ũ�ȣ�ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��4���Ȼ����Һ��笠�����ˮ����Һ�����ԣ�NH4++H2O?NH3•H2O+H+��K=$\frac{c��{H}^{+}��c��N{H}_{3}•{H}_{2}O��}{c��N{{H}_{4}}^{+}��}$=$\frac{c��{H}^{+}��c��N{H}_{3}•{H}_{2}O��}{c��N{{H}_{4}}^{+}��}$��$\frac{c��O{H}^{-}��}{c��O{H}^{-}��}$=$\frac{Kw}{Kb}$��һˮ�ϰ���������Ũ�Ƚ�����ͬ����õ�������Ũ�ȣ�������ҺPH��
��� �⣺��1����Ӧ��ֱ��ں��º��������к;��Ⱥ��������н��У����߾��ﵽƽ������������¶�����ƽ��������У�������̼Ũ������c��CO2������С��c��CO2����Ե������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
��Ӧ��2NH3��g��+CO2��g��?NH2CO2NH4��s����H1=-159.47kJ•mol-1
��Ӧ��NH2CO2NH4��s��?CO��NH2��2��s��+H2O��g����H2=+72.49kJ•mol-1
��˹���ɼ����+��õ��ܷ�Ӧ��2NH3��g��+CO2��g��?CO��NH2��2��s��+H2O��g����H3=-159.47kJ•mol-1+��+72.49kJ•mol-1��=-86.98KJ/mol��
�ʴ�Ϊ��С�ڣ�-86.98KJ/mol��
��2��0-t1ʱ���ڸû�ѧ��Ӧ����v��CO2��=$\frac{��c}{��t}$=$\frac{0.1mol/L-0.025mol/L}{{t}_{1}}$=$\frac{0.075}{{t}_{1}}$mol/��L•min������ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȼ��㰱���ķ�Ӧ����V��NH3��=2v��CO2��=2��$\frac{0.075}{{t}_{1}}$mol/��L•min��=$\frac{0.15}{{t}_{1}}$mol/��L•min�����ں����½�0.4mol NH3��0.2mol CO2�����ݻ�Ϊ2L���ܱ������У��ﵽƽ��ʱ��
2NH3��g��+CO2��g��?NH2CO2NH4��s��
��ʼ����mol/L�� 0.2 0.1 0
�仯����mol/L�� 0.15 0.075
ƽ������mol/L�� 0.05 0.025
t1ʱ�ﵽƽ�������c��CO2����ʱ��t�仯����������ͼ2��ʾ���������������䣬t1ʱ���������ѹ����1L��������̼Ũ��Ӧ����0.05mol/L��ѹǿ����ƽ��������У������������ǹ��壬���Դﵽƽ��״̬��������̼Ũ�ȱ��ֲ��䣬�ݴ˻����仯����Ϊ��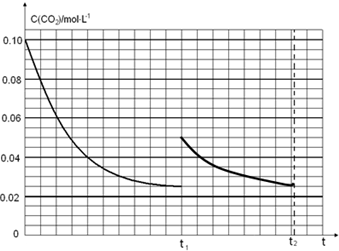 ��
��
�ʴ�Ϊ��$\frac{0.15}{{t}_{1}}$mol/��L•min���� ��
��
��3����150��-170��֮�䣬CO2ת���ʳ���������ı仯���ƣ���170��C������¶����ߣ�������̼ת���ʼ�С����Ӧ�Ƿ��ȷ�Ӧ������ƽ��������У�������̼ת���ʼ�С������170��C��Ӧ�ﵽƽ��״̬����150��-170��֮�䣬CO2ת���ʳ���������ı仯���Ƶ�ԭ������150��-170��֮�䷴Ӧδ�ﵽƽ��״̬���¶�Խ�߷�Ӧ����Խ�죬CO2ת���ʾ�Խ��ƽ�⿿£����150��ʱ����2molNH3��1molCO2����aL�ܱ������У���180��Cʱ������̼ת����Ϊ75%��������̼�������ʵ���Ϊ75%��1mol=0.75mol��������м�����ʽ�õ�
2NH3��g��+CO2��g��?CO��NH2��2��s��+H2O��g��
��ʼ����mol�� 2 1 0 0
�仯����mol��0.75��2 0.75 0.75 0.75
ƽ������mol��0.5 0.25 0.75 0.75
ƽ�ⳣ��K=$\frac{\frac{0.75}{a}}{��\frac{0.5}{a}��^{2}��\frac{0.25}{a}}$=12a2��mol/L��2��
�ʴ�Ϊ��12a2��mol/L��2��
��4���Ȼ����Һ��笠�����ˮ����Һ�����ԣ�NH4++H2O?NH3•H2O+H+��K=$\frac{c��{H}^{+}��c��N{H}_{3}•{H}_{2}O��}{c��N{{H}_{4}}^{+}��}$=$\frac{c��{H}^{+}��c��N{H}_{3}•{H}_{2}O��}{c��N{{H}_{4}}^{+}��}$��$\frac{c��O{H}^{-}��}{c��O{H}^{-}��}$=$\frac{Kw}{Kb}$=$\frac{1{0}^{-14}}{1.8��1{0}^{-5}}$��ˮ�����ɵ�һˮ�ϰ�Ũ�Ƚ��Ƶ���������Ũ�ȣ���c2��H+��=K��c��NH4+����c��H+��=$\sqrt{Kc��N{{H}_{4}}^{+}��}$=$\sqrt{\frac{1{0}^{-14}}{1.8��1{0}^{-5}}��0.2}$��10-5mol/L��PH=5��
�ʴ�Ϊ��5��
���� ���⿼�����Ȼ�ѧ����ʽ��д����ѧ��Ӧ���ʺ�ƽ�ⳣ���ļ��㡢ƽ��Ӱ�����غ�ͼ����Ʒ���������ˮ�����ҺPH�ļ��㷽����֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ӽṹʾ��ͼ��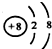 ���Ա�ʾ16O2-��Ҳ���Ա�ʾ18O2- ���Ա�ʾ16O2-��Ҳ���Ա�ʾ18O2- | |
| B�� | ����ģ�ͣ� ���Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼���� ���Ա�ʾ������ӣ�Ҳ���Ա�ʾ���Ȼ�̼���� | |
| C�� | �Ȼ�淋ĵ���ʽΪ��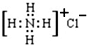 | |
| D�� | ������̼���ӵı���ģ���ǣ�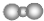 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �٢ۢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
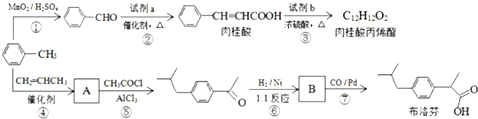
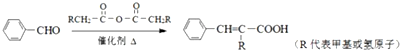
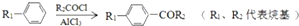
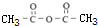 ��
��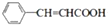 +CH2=CHCH2OH$��_{��}^{Ũ����}$
+CH2=CHCH2OH$��_{��}^{Ũ����}$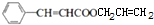 +H2O��
+H2O�� ��
��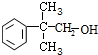 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Ԫ�� | X | Y | Z | W |
| ԭ�Ӱ뾶/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A�� | Y��Z��W�������ڱ���ͬһ���� | B�� | ͨ��״���µò���������YZ2 | ||
| C�� | X��Z�γɵĻ����ﲻ���Ǽ��Լ� | D�� | X��Z��W�γɵĻ�����Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| ��ֵ | ||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
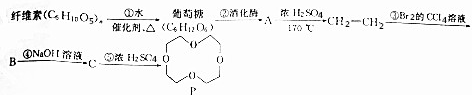
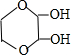 ��
��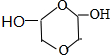 ����дһ�֣��������������칹��
����дһ�֣��������������칹���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
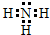 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com