
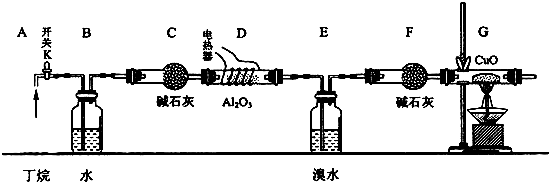

分析 (1)根据实验时应先检验气密性,赶出内部气体,再加热;
(2)根据可燃气体的验纯操作方法分析;
(3)通过观察气泡,可以控制气体的流速;
(4)甲烷和氧化铜发生氧化还原反应生成二氧化碳、铜和水;
(5)①互不相溶的液体采用分液的方法分离,互溶的液体采用蒸馏的方法分离;
②亚硫酸钠具有还原性,能和溴反应除去溴.
(6)E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,丁烷的裂解中,生成乙烯的物质的量和乙烷的物质的量相等,甲烷和丙烯的物质的量相等,再结合原子守恒计算甲烷的物质的量;
解答 解:(1)应先检查整套装置的气密性,排出装置中的空气,再给D、G装置加热,所以正确的操作顺序为:②③①,
故答案为:②③①;
(2)打开K,使丁烷气依次流经各装置,
故答案为:打开K,使丁烷气依次流经各装置;
(3)B装置中盛有水,可以通过观察B中产生的气泡快慢来控制气体的流速,
故答案为:通过观察气泡,调节K,控制气体流速;
(4)甲烷和氧化铜发生氧化还原反应生成二氧化碳、铜和水,反应的化学方程式CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2H2O+4Cu,
故答案为:CH4+4CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+2H2O+4Cu;
(5)混合物中含有有机物和溴,向混合物中加入亚硫酸钠溶液后,溶液分层,采用分液的方法分离出混合物和有机层,互溶的液体采用蒸馏的方法分离,分离出甲和乙,
①互不相溶的液体采用分液的方法分离,互溶的液体采用蒸馏的方法分离,所以操作I、操作II分别是分液、蒸馏,
故答案为:分液;蒸馏;
②亚硫酸钠具有还原性,能和强氧化性物质溴反应而除去溴,反应的离子方程式为:SO32-+Br2+H2O=SO42-+2Br-+2H+,
故答案为:SO32-+Br2+H2O=SO42-+2Br-+2H+.
(6)测定裂解气中CH4和C2H6的比例关系,E、F吸收的是烯烃,G减少的质量是氧化铜中的氧元素质量,丁烷的裂解中,生成乙烯的物质的量和乙烷的物质的量相等,甲烷和丙烯的物质的量相等,再结合原子守恒计算甲烷的物质的量,该实验要测定的数据有:①E和F装置的总质量反应前后的变化量,
②G装置中固体质量反应前后的变化量,
故答案为:G装置中固体质量反应前后的变化量;
点评 本题考查实验操作、实验计算、物质分离和提纯的方法等知识点,题目难度中等,难点是计算甲烷和甲烷的物质的量之比,明确质量增加的量和质量减少的量分别是什么物质是解本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50℃时,测定某NaNO2溶液的pH=8,则溶液中c(Na+)-c(NO2-)=9.9×10-7mol•L-1 | |||||||||
| B. | NaHSO3水溶液中存在关系:c(H2SO3)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | |||||||||
| C. | 一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| |||||||||
| D. | 已知25℃时,有关弱电解质的电离平衡常数:HCN:Ka=4.9×10-10;H2CO3:Ka1=4.3×10-7Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
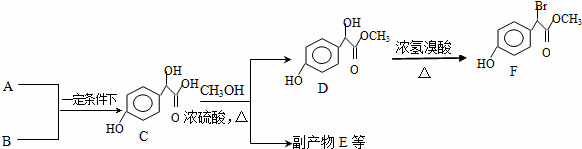
.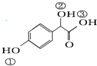 )中①、②、③(从左到右编号)3个-OH的酸性由弱到强的顺序是:③>①>②.
)中①、②、③(从左到右编号)3个-OH的酸性由弱到强的顺序是:③>①>②.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
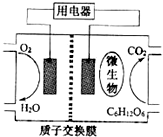
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-═6CO2+24H+ | |
| C. | 放电过程中,质子(H+)从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D元素在元素周期表中的位置为第四周期第Ⅷ族
;D元素在元素周期表中的位置为第四周期第Ⅷ族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
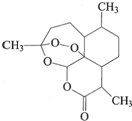 中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )
中国药学家屠呦呦获得2015年诺贝尔生理医学奖.她发现了青蒿素--一种用于治疗疟疾的药物,挽救了全球数百万人的生命.青蒿素的结构如图所示.下列有关青蒿素的说法不正确的是( )| A. | 分子式为C15H22O5 | |
| B. | 易溶于乙醚等有机溶剂 | |
| C. | 可发生取代反应,不能发生氧化反应 | |
| D. | 在强酸或强碱性溶液中不能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| C. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com