
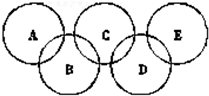
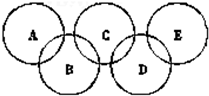
 如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
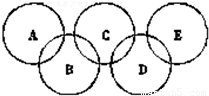
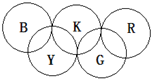 如图所示,形成奥运五环的B、K、R、Y和G均为元素周期表前20号元素的代号,它们还满足下列关系:
如图所示,形成奥运五环的B、K、R、Y和G均为元素周期表前20号元素的代号,它们还满足下列关系:



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
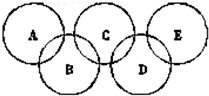 如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省汕头市濠江区金山中学高三(上)期末化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com