
下列溶液中,微粒浓度关系正确的是
A.常温下,pH=6的由醋酸与醋酸钠组成的混合溶液中:c(Na+)>c(CH3COO-)
B. 将Cl2通入过量KOH溶液中:c(ClO-)+c(Cl-)=c(K+)
C. 0.1mol·L-1的Na2S溶液中:c(OH-)= c(H+)+c(HS-)+2 c(H2S)
D.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:
c(Cl-)> c(H+)> c(NH4+)> c(OH-)
【知识点】溶液中的离子浓度 H2 H6
【答案解析】C 解析:A、根据电荷守恒式:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)常温下,pH=6的由醋酸与醋酸钠组成的混合溶液中:c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),故A错误;B、将Cl2通入过量KOH溶液中:c(ClO-)+c(Cl-)>c(K+),故B错误;C、0.1mol·L-1的Na2S溶液中水电离的氢氧根浓度一定等于水电离的氢离子浓度:c(OH-)= c(H+)+c(HS-)+2 c(H2S),故C正确;D、室温下,pH=2的盐酸与pH=12的氨水等体积混合,氨水过量,所得溶液显碱性,故D错误。
故答案选C
【思路点拨】本题考查了溶液中的离子浓度比较,注意溶液的酸碱性,并借助几个守恒式进行分析。


科目:高中化学 来源: 题型:
可确认发生了化学平衡移动的是( )
A.化学反应速率发生了改变
B.有气态物质参加的可逆反应达到平衡后,改变了压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
分类法在化学学科发展中起到了非常重要的作用,下列分类依据合理的是
①根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔现象分为溶液、胶体和浊液
④根据组成元素的种类将纯净物分为单质和化合物
⑤根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
A.②④ B.②③④ C.①③⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:

(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:___ 。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 (写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是:
。
(5)“焙烧2”的目的是: 。
(6)与焙烧2产生的气体组成元素相同的化合物是 ,该物质与空气形成一种环保型碱性燃料电池,其负极反应式为
(7) Pd中加入王水的反应可以表示为Pd+HCl+HNO3→A+B↑+H2O(未配平)。其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.c(NH4+) / c (NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
反应Ag)+3Bg)===2Cg)+2Dg)在四种不同情况下的反应速率分别为
①vA)=0.45 mol·L-1·min-1
②vB)=0.6 mol·L-1·s-1
③vC)=0.4 mol·L-1·s-1
④vD)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是 )。
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4s,白磷)+5O2g)===P4O10s)
ΔH1=-2 983.2 kJ·mol-1
Ps,红磷)+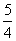 O2g)===
O2g)===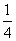 P4O10s)
P4O10s)
ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为
____________________________________________________。
2)已知298 K时白磷不完全燃烧的热化学方程式为P4s,白磷)+3O2g)===P4O6s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学腐蚀与电化学腐蚀的说法中,错误的是
( )。
A.均是被腐蚀的金属失去电子的过程
B.均是需要有氧气参加的反应
C.化学腐蚀与电化学腐蚀往往是同时发生的
D.在无水环境中的腐蚀一般不属于电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
已知,一个可逆反应,若正反应为自发过程,则其逆反应为非自发过程,反之,亦然。
(1)已知2CO(g)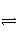
 CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS____0(填“大于”、“小于”或“等于”,下同);当体系温度高于980 K时,估计ΔH-TΔS____0。
CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS____0(填“大于”、“小于”或“等于”,下同);当体系温度高于980 K时,估计ΔH-TΔS____0。
(2)电子工业中清洗硅片上的SiO2(s)的反应为
SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)
ΔH(298.15 K)=-94.0 kJ·mol-1
ΔS(298.15 K)=-75.8 J·mol-1·K-1,
设ΔH和ΔS不随温度而变化,则此反应自发进行的温度是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com