
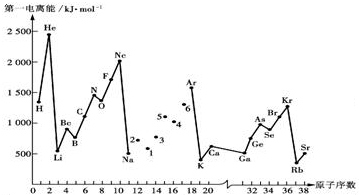
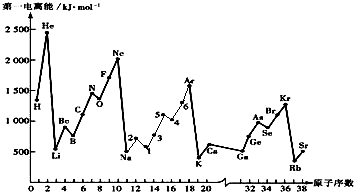
 ;
; ;
;

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
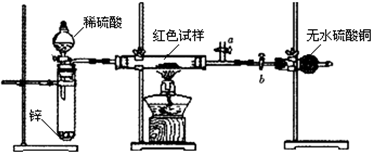 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L CH3COONa溶液和0.1mol/L HCl溶液等体积混合之后:c(Na+)=2c(Cl-)=c(CH3COO-)+c(CH3COOH)=0.2mol/L |
| B、0.1mol/LNa2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D、25℃时,向10mL pH=4的盐酸中,加入pH=10的一元碱BOH溶液至pH刚好等于7,则反应后的溶液总体积:V总≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
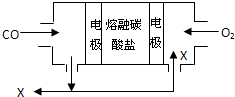 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
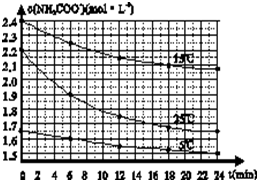 某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )
某研究性活动小组在实验室用三份不同初始浓度的氨基甲酸铵(NH2COONH4)溶液在不同温度下进行水解实验:NH2COONH4+2H2O?NH4HCO3+NH3?H2O,经测得c(NH2COO-)与反应时间的关系如图所示.据图判断下列说法正确的是( )| A、0~12 min,初始浓度越大的实验,水解反应速率越大 |
| B、c(NH2COO-)将随反应时间的不断延长而一直减小至0 |
| C、25℃时0~6 min,v(NH2COO-)为0.05 mol?L-1?min-1 |
| D、15℃时,第30 min时,c(NH2COO-)为2.0 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a1、a2均减小 |
| B、a1、a2均增大 |
| C、a1增大,a2减小 |
| D、a1减小,a2增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
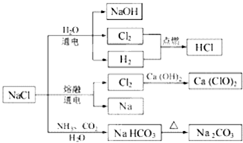
| A、25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B、石灰乳与Cl2的反应中,Cl2是氧化剂,Ca(OH)2是还原剂 |
| C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D、如图所示转化反应中有4个反应属于氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com