
| A. | 甲烷和乙醇 | B. | 丙烯和丙烷 | C. | 乙酸和乙酸乙酯 | D. | 苯和乙烯 |
分析 根据有机物分子中含碳碳双键、C=O键、-CHO及苯环的物质可发生加成反应,如:烯烃、炔烃、醛类、苯及其同系物等,注意-COOH不能发生加成反应,以此来解答.
解答 解:A.甲烷为饱和烃,乙醇为饱和一元醇,不能发生加成反应,故A错误;
B.丙烷为饱和烃,不能发生加成反应,故B错误;
C.乙酸分子中羰基不能发生加成反应,乙酸乙酯的酯基不能发生加成反应,故C错误;
D.苯可与氢气发生加成反应生成环己烷,乙烯含有碳碳双键,可发生加成反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意结构与性质的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | NaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶于适量蒸馏水 |
| C | 检验溶液中是否含NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻羟基苯甲酸与NaHCO3溶液反应 | |
| B. | 2-氯丁烷( )与NaOH的乙醇溶液共热 )与NaOH的乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
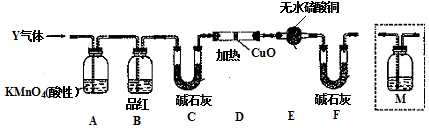
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸反应 | ||
| C. | 炽热的炭与CO2反应 | D. | 酸碱中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为解决能源短缺问题,工业生产中应合理利用化学能.
为解决能源短缺问题,工业生产中应合理利用化学能.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲和丙均可与酸性KMnO4溶液发生反应 | |
| B. | 反应(1)的无机试剂是液溴和铁粉,实际起催化作用的是FeBr3 | |
| C. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 | |
| D. | 反应(2)属于取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com