
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
分析 短周期元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,则A为氢元素;D是同周期中金属性最强的元素,处于ⅠA族,D的原子序数比H元素至少大3,可推知D为Na元素;B原子的价电子数等于该元素最低化合价的绝对值,处于ⅣA族,结合原子序数可知,B为碳元素;C与D能形成D2C和D2C2两种化合物,则C为O元素;E形成负一价离子,则E为Cl,氯离子与H2O2含有相同的电子数.
(1)A、C、D形成的化合物为NaOH;
(2)已知:①Cl-Cl→2Cl•;△H=+a kJ•mol-1
②2H•→H-H;△H=-b kJ•mol-1
③Cl•+H•→H-Cl;△H=-c kJ•mol-1,
根据盖斯定律,①-②+③×2得:H2(g)+Cl2(g)=2HCl(g);
(3)①发生反应:CO(g)+2H2(g)?CH3OH(g),根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
②用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算平衡常数;
③A.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为amol,表示出甲中CO转化率、乙中甲醇的转化率;
B.丙与甲相比,可以等效为在甲的基础上,压强增大一倍;
C.甲、乙为完全等效平衡,平衡时对应各组分的物质的量相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;
D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍;
E.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为bmol,根据热化学方程式表示出甲中放出热量Q1、乙中吸收的热量Q2;
F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的CO的物质的量大于甲中的2倍;
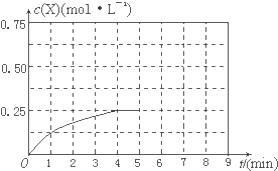
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,瞬间X的浓度变为原来的2倍,平衡正向移动,若在第8min达到新的平衡时A2的总转化率为65.5%,平衡时X为2mol×65.5%×$\frac{1}{2}$=0.655mol,平衡时X的浓度为0.655mol/L.
解答 解:短周期元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,则A为氢元素;D是同周期中金属性最强的元素,处于ⅠA族,D的原子序数比H元素至少大3,可推知D为Na元素;B原子的价电子数等于该元素最低化合价的绝对值,处于ⅣA族,结合原子序数可知,B为碳元素;C与D能形成D2C和D2C2两种化合物,则C为O元素;E形成负一价离子,则E为Cl,氯离子与H2O2含有相同的电子数.
(1)A、C、D形成的化合物为NaOH,属于离子化合物,氢氧根离子中氧原子与氢原子之间形成共价键,故含有离子键、共价键,
故答案为:离子键、共价键;
(2)已知:①Cl-Cl→2Cl•;△H=+a kJ•mol-1
②2H•→H-H;△H=-b kJ•mol-1
③Cl•+H•→H-Cl;△H=-c kJ•mol-1,
根据盖斯定律,①-②+③×2得:H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJ•mol-1;
(3)①发生反应:CO(g)+2H2(g)?CH3OH(g),4min到达平衡时,生成0.5molCH3OH,则v(CH3OH)=$\frac{\frac{0.5mol}{2L}}{4min}$=0.0625mol/(L.min),速率之比等于化学计量数之比,则v(H2)=2v(CH3OH)=$\frac{\frac{0.5mol}{2L}}{4min}$=0.125mol/(L.min),
故答案为:0.125mol/(L.min);
②CO的起始浓度=$\frac{1mol}{2L}$=0.5mol/L,氢气的起始浓度=$\frac{2mol}{2L}$=1mol/L,达到平衡时c(CH3OH)=$\frac{0.5mol}{2L}$=0.25mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始(mol/L):0.5 1 0
变化(mol/L):0.25 0.5 0.25
平衡(mol/L):0.25 0.5 0.25
所以平衡常数k═$\frac{0.25}{0.25×0.{5}^{2}}$=4
故答案为:4;
②A.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为amol,甲中CO转化率α1=$\frac{1-a}{1}$=1-a,平衡时甲醇的物质的量=(1-a)mol,乙中参加反应的甲醇为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;
B.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应方向移动,转化率增大,即α3>α1 ,故B错误;
C.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故n2=0.5,n3>1.0mol,故C错误;
D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强相等,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2 ,故D正确;
E.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为bmol,则甲中参加反应的CO为(1-b)mol,放出的热量Q1=d(1-b),乙中参加反应的甲醇为bmol,吸收的热量Q2=bd,故Q1+Q2=d(1-b)+bd=d,故E正确;
F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的CO的物质的量大于甲中的2倍,则Q3>2Q1,故F错误,
故答案为:ADE;
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,瞬间X的浓度变为原来的2倍,平衡正向移动,若在第8min达到新的平衡时A2的总转化率为65.5%,平衡时X为2mol×65.5%×$\frac{1}{2}$=0.655mol,平衡时X的浓度为0.655mol/L,第5min 到新平衡时X的物质的量浓度的变化曲线为: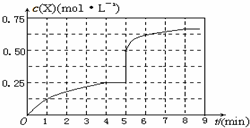 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及元素推断、化学平衡的计算、热化学方程式书写等,(3)中③为易错点、难点,要准确理解等效平衡问题,注意对等效平衡规律的理解,注意对结论的理解掌握,题目难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 可能是不同的分子与原子 | B. | 可能是不同的离子 | ||
| C. | 可能是一种离子和一种分子 | D. | 可能是某位素的同位素原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
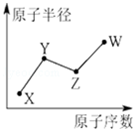 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) | B. | c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
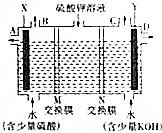
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N为乙酸 | |
| B. | 过程①中可加入LiAlH4等还原剂将乙醇转化为N | |
| C. | 过程②如果加热一段时间后发现忘记加瓷片,应停止反应,待冷却后补加 | |
| D. | 可用饱和碳酸钠溶液除去乙酸乙酯中混有的N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
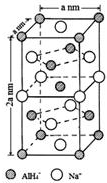 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非极性分子中的原子一定无孤电子对 | |
| B. | 平面三角型分子一定是非极性分子 | |
| C. | 二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′ | |
| D. | ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com