
在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
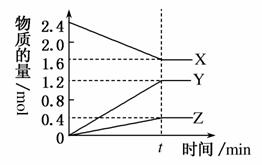
(1)该反应的化学方程式是___________________________。
(2)反应起始至t,Y的平均反应速率是_________________。
(3)X的转化率是_____________________________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和另一种常见气体.进一步研究NH3生成量与温度的关系(其它条件均相同),部分实验数据见下表:
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
回答下列问题:
(1)写出该反应的化学方程式
(2)该反应的焓变△H 0(填“>”、“<”或“=”)
(3)请在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
(4)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(5)已知:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol
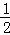 N2(g)+2H2(g)+
N2(g)+2H2(g)+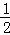 Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
黄曲霉素是污染粮食的真菌霉素,其结构如图,人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.下列的说法正确的是( )

|
| A. | 黄曲霉素能发生取代反应和消去反应 |
|
| B. | 1mol黄曲霉素能与6mol氢气发生加成反应 |
|
| C. | 1mol黄曲霉素能与含1mol NaOH的水溶液完全反应 |
|
| D. | 黄曲霉素能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )

A.反应的化学方程式为:2MN
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在密闭容器中进行反应3SiCl4(g)+2N2(g)+6H2(g)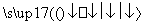 Si3N4(s)+12HCl(g),能表示上述反应达到化学平衡状态的是( )
Si3N4(s)+12HCl(g),能表示上述反应达到化学平衡状态的是( )
A.3v逆(N2)=v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2):c(H2):c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | ⅠA族元素单质的熔点从上往下逐渐降低 |
|
| B. | 分子晶体中一定存在共价键 |
|
| C. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
|
| D. | 同周期非金属氧化物对应的水化物的酸性从左往右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
|
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com