
 可简写为
可简写为
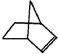
 ,系统命名为甲苯.
,系统命名为甲苯.分析 Ⅰ.(1)降冰片烯为环状烃,且含有碳碳双键;
(2)含有C=C键,结合烯烃的性质来分析解答;
Ⅱ.(1)根据C原子数可判断属于芳香烃的为甲苯;
(2)物质Q中含有3种氢原子.
解答 Ⅰ.(1)降冰片烯为环状烃,且含有碳碳双键,则属于环烃,也属于烯烃,不含苯环,则不属于芳香烃,故答案为:b;
(2)含有C=C键,具有烯烃的性质,则不溶于水,常温常压下不为气体,能发生加成反应和氧化反应,故答案为:a、d;
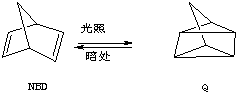
Ⅱ.(1)NBD的分子式为C7H8,属于芳香烃的为甲苯,结构简式为 ,故答案为:
,故答案为: ;甲苯;
;甲苯;
(2)物质Q中含有3种氢原子,一氯代物共有3种,故答案为:3.
点评 本题考查有机物的结构和性质,为高考常见题型,明确有机物的结构与性质的关系即可解答,注意把握烯烃的性质来解答,题目难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n+4 | B. | n+6 | C. | n+8 | D. | n+10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Na2O2和足量CO2反应转移2 NA个电子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
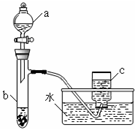 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
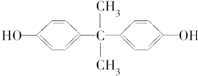 ).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题:
).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题: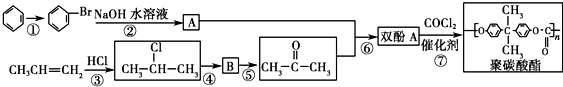
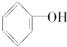 .
.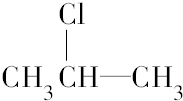 按系统命名法的名称为2-氯丙烷.
按系统命名法的名称为2-氯丙烷.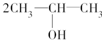 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O.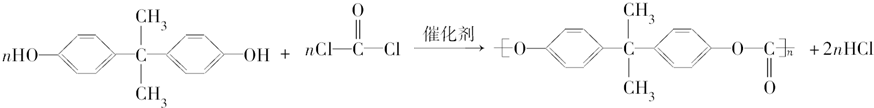 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4+O2═N2+2H2O△H=-534.4 kJ•mol-1 | |
| B. | N2H4+O2═N2+2H2O△H=-1 068.8 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4 kJ•mol-1 | |
| D. | $\frac{1}{2}$N2H4(g)+$\frac{1}{2}$O2(g)═$\frac{1}{2}$N2(g)+H2O(g)△H=+267.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
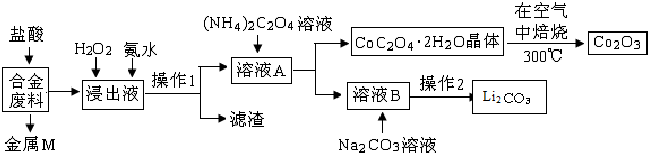
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
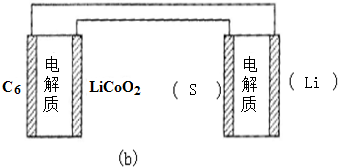 中填写“Li”或“S”,以达到给锂硫电池充电的目的.
中填写“Li”或“S”,以达到给锂硫电池充电的目的.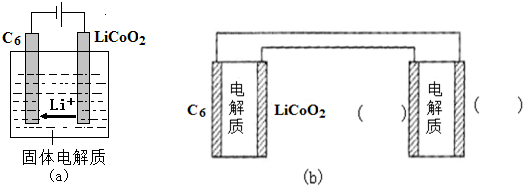
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com