
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体 熔点为-40℃,沸点为71℃ 不溶于冷水,易溶于有机溶剂 密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
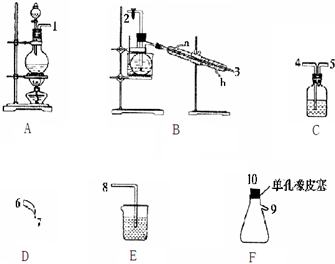
分析 (1)(2)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气.
(3)A装置中利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水;
(4)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可知控制蒸馏温度;
(5)E装置的锥形瓶内有黄色油状液体为NCl3,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色,说明NCl3没有漂白性,若取该液体滴入热水中,NCl3发生水解,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,说明有碱性物质与强氧化性物质生成,水解应生成氨气与HClO.
解答 解:(1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:1、4、5、2、3、6、7、10、9、8,
故答案为:1、4、5、2、3、6、7、10、9、8;
(2)C装置中盛放饱和食盐水,吸收除去HCl,E装置中盛放氢氧化钠溶液,吸收氯气,防止污染空气,
故答案为:饱和食盐水;NaOH溶液;
(3)A装置中利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl,反应方程式为:3Cl2+NH4Cl═NCl3+4HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可知控制蒸馏温度为71~95℃,
故答案为:3Cl2+NH4Cl═NCl3+4HCl;71~95℃;
(5)E装置的锥形瓶内有黄色油状液体为NCl3,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色,说明NCl3没有漂白性,若取该液体滴入热水中,NCl3发生水解,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,说明有碱性物质与强氧化性物质生成,水解应生成氨气与HClO,反应方程式为:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3,
故答案为:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3.
点评 本题考查物质制备与性质探究实验,关键是理解原理和各装置作用,注意对题目信息获取与迁移应用,有利于培养学生的实验能力、分析能力,难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用加热的方法区分纯碱和小苏打 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
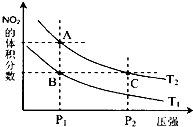 对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.
对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是bc.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 紫色石蕊试液中滴入氢硫酸变红的原因是:H2S?2H++S2- | |
| C. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
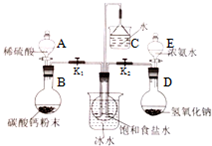 某课外活动小组模拟工业制备纯碱,方案如下:
某课外活动小组模拟工业制备纯碱,方案如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中含有1 mol MgCl2 | |
| B. | 1 L溶液中含有1 mol Cl- | |
| C. | 将95 g MgCl2溶于1 000 g水中配成溶液 | |
| D. | 1 L溶液中含有95 g MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com