
¹¤ŅµÉĻæÉÓĆŅŌĻĀ·½°øŹ¹ŅūÓĆĖ®ÖŠNO3-ŗ¬Įæ“ļ±ź”£
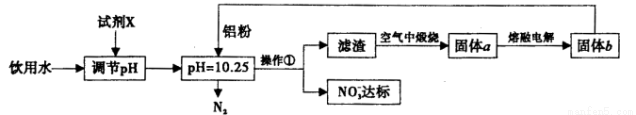
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µ÷½ŚpH²»ŅĖ¹ż“ó»ņ¹żŠ”£¬·ńŌņ»įŌģ³ÉAlµÄĄūÓĆĀŹ½µµĶ£»ŹŌ¼ĮXæÉŃ”ÓĆ________£ØĢīŠņŗÅ£©”£
A NaOH B Ca(OH)2 C NH3.H2O D CuO E CO2
£Ø2£©Į÷³ĢÖŠ²Ł×÷¢ŁµÄĆū³ĘĪŖ__________£¬ČōŌŚŹµŃéŹŅÖŠ½ųŠŠ“Ė²Ł×÷£¬ĖłŠčŅŖµÄ²£Į§ŅĒĘ÷ŹĒ___________”£
£Ø3£©Š“³öČÜŅŗÖŠĀĮ·ŪŗĶNO3-·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ______________________”£
£Ø4£©»¹æÉÓĆŅŌĻĀ»Æѧ·“Ó¦Ź¹ŅūÓĆĖ®ÖŠNO3-ŗ¬Įæ“ļ±ź£¬²śĪļÖ®Ņ»ŹĒæÕĘųµÄÖ÷ŅŖ³É·Ö”£Ķź³ÉĻĀĮŠĄė×Ó·½³ĢŹ½£ŗ

 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ½ĖÕŹ”øßČżÉĻµŚ¶ž“Ī½×¶Ī²ā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
¹¤ŅµÉĻæÉÓĆČķĆĢæó(Ö÷ŅŖ³É·ÖŹĒMnO2)ŗĶ»ĘĢśæó(Ö÷ŅŖ³É·ÖŹĒFeS2)ĪŖÖ÷ŅŖŌĮĻÖʱøøߊŌÄÜ“ÅŠŌ²ÄĮĻĢ¼ĖįĆĢ(MnCO3)”£Ę乤ŅµĮ÷³ĢČēĻĀ£ŗ

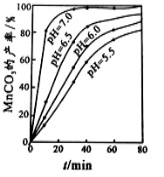
ŅŃÖŖ£ŗMnCO3ÄŃČÜÓŚĖ®”¢ŅŅ“¼£¬³±ŹŖŹ±Ņ×±»æÕĘųŃõ»Æ£¬100”ęæŖŹ¼·Ö½ā”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©¾»»Æ¹¤ŠņµÄÄæµÄŹĒ³żČ„ČÜŅŗÖŠµÄCu2+”¢Ca2+µČŌÓÖŹ”£Čō²āµĆĀĖŅŗÖŠc(F-)=0.01mol/L-1£¬ĀĖŅŗÖŠ²ŠĮōµÄc(Ca2+)= ”²ŅŃÖŖ£ŗKsp(CaF2)=1.46”Į10-10”³
£Ø2£©³ĮĆĢ¹¤ŠņÖŠ£¬298K”¢c(Mn2+)ĪŖ1.05 mol/L-1Ź±£¬ŹµŃé²āµĆMnCO3µÄ²śĀŹÓėČÜŅŗpH”¢·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£øł¾ŻĶ¼ÖŠŠÅĻ¢µĆ³öµÄ½įĀŪŹĒ ”£
£Ø3£©“Ó³ĮĆĢ¹¤ŠņÖŠµĆµ½“æ¾»MnCO3µÄ²Ł×÷·½·ØŹĒ£ŗ¹żĀĖ”¢ ”£
£Ø4£©ĪŖ²ā¶ØijČķĆĢæóÖŠ¶žŃõ»ÆĆĢµÄÖŹĮæ·ÖŹż£¬×¼Č·³ĘĮæ1.20gČķĆĢæóѳʷ£¬¼ÓČė2.68g²ŻĖįÄĘ¹ĢĢ壬ŌŁ¼ÓČė×ćĮæµÄĻ”ĮņĖį²¢¼ÓČČ(ŌÓÖŹ²»²Ī¼Ó·“Ó¦)£¬³ä·Ö·“Ó¦ŗóĄäČ“£¬½«ĖłµĆČÜŅŗ×ŖŅʵ½250mLČŻĮæĘæÖŠÓĆÕōĮóĖ®Ļ”ŹĶÖĮæĢ¶Č£¬“ÓÖŠČ”³ö25.0mL£¬ÓĆ0.0200mol”¤L-1øßĆĢĖį¼ŲČÜŅŗ½ųŠŠµĪ¶Ø£¬µ±µĪČė20.0mLČÜŅŗŹ±Ē”ŗĆĶźČ«·“Ó¦”£
ŅŃÖŖøßĆĢĖį¼Ų”¢¶žŃõ»ÆĆĢŌŚĖįŠŌĢõ¼žĻĀ¾łÄܽ«²ŻĖįÄĘ(Na2C2O4)Ńõ»Æ£ŗ
2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2ӟ+ 8H2O
MnO2 + C2O42- + 4H+ == Mn2+ + 2CO2ӟ+ 2H2O
ĒóøĆČķĆĢæóÖŠ¶žŃõ»ÆĆĢµÄÖŹĮæ·ÖŹż (Š“³ö¼ĘĖć¹ż³Ģ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģÕć½Ź”øßČżÉĻѧʌµŚČż“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹Ų»ÆѧÓĆÓļ±ķ“ļÕżČ·µÄŹĒ
A£®H2O2µÄµē×ÓŹ½£ŗ
B£®¶žŃõ»Æ¹čµÄ·Ö×ÓŹ½£ŗSiO2
C£®ŅŅĖį·Ö×ÓµÄĒņ¹÷Ä£ŠĶ£ŗ
D£®Ąė×Ó½į¹¹Ź¾ŅāĶ¼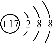 £¬æÉŅŌ±ķŹ¾35Cl££¬Ņ²æÉŅŌ±ķŹ¾37Cl£
£¬æÉŅŌ±ķŹ¾35Cl££¬Ņ²æÉŅŌ±ķŹ¾37Cl£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğø£½ØŹ”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©·“Ó¦Fe(s)+CO2(g) FeO(s)+CO(g) ”÷H1£¬Ę½ŗā³£ŹżĪŖK1£»
FeO(s)+CO(g) ”÷H1£¬Ę½ŗā³£ŹżĪŖK1£»
·“Ó¦Fe(s)+H2O(g) FeO(s)+H2(g) ”÷H2£¬Ę½ŗā³£ŹżĪŖK2£»ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ£ŗ
FeO(s)+H2(g) ”÷H2£¬Ę½ŗā³£ŹżĪŖK2£»ŌŚ²»Ķ¬ĪĀ¶ČŹ±K1”¢K2µÄÖµČēĻĀ±ķ£ŗ
700”ę | 900”ę | |
K1 | 1£®47 | 2£®15 |
K2 | 2£®38 | 1£®67 |
¢Ł·“Ó¦CO2(g) + H2(g) CO(g) + H2O(g) ”÷H£¬Ę½ŗā³£ŹżĪŖK£¬Ōņ”÷H= £ØÓĆ”÷H1ŗĶ”÷H2±ķŹ¾£©£¬K= £ØÓĆK1ŗĶK2±ķŹ¾£©£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g) + H2(g)
CO(g) + H2O(g) ”÷H£¬Ę½ŗā³£ŹżĪŖK£¬Ōņ”÷H= £ØÓĆ”÷H1ŗĶ”÷H2±ķŹ¾£©£¬K= £ØÓĆK1ŗĶK2±ķŹ¾£©£¬ĒŅÓÉÉĻŹö¼ĘĖćæÉÖŖ£¬·“Ó¦CO2(g) + H2(g) CO(g) + H2O(g)ŹĒ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©”£
CO(g) + H2O(g)ŹĒ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©”£
¢ŚÄÜÅŠ¶ĻCO2(g) + H2(g) CO(g) + H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ £ØĢīŠņŗÅ£©”£
CO(g) + H2O(g)“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ £ØĢīŠņŗÅ£©”£
A£®ČŻĘ÷ÖŠŃ¹Ēæ²»±ä B£®»ģŗĻĘųĢåÖŠc(CO)²»±ä
C£®vÕż(H2)= vÄę(H2O) D£®c(CO)= c(CO2)
£Ø2£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņijĆܱÕČŻĘ÷ÖŠ¼ÓČė×ćĮæĢś·Ū²¢³äČėŅ»¶ØĮæµÄCO2ĘųĢ壬·¢Éś·“Ó¦Fe(s)+CO2(g) FeO(s)+CO(g) ”÷H > 0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
FeO(s)+CO(g) ”÷H > 0£¬CO2µÄÅضČÓėŹ±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
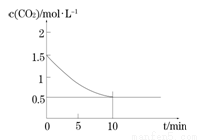
¢Ł øĆĢõ¼žĻĀ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ £»ČōĢś·Ū×ćĮ棬CO2µÄĘšŹ¼ÅضČĪŖ2.0 mol”¤L£1£¬ŌņĘ½ŗāŹ±CO2µÄÅضČĪŖ____________mol”¤L£1”£
¢ŚĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹Ę½ŗāŹ±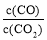 Ōö“óµÄŹĒ__________£ØĢīŠņŗÅ£©”£
Ōö“óµÄŹĒ__________£ØĢīŠņŗÅ£©”£
A£®ÉżøßĪĀ¶Č B£®Ōö“óŃ¹Ēæ
C£®³äČėŅ»¶ØĮæµÄCO2 D£®ŌŁ¼ÓČėŅ»¶ØĮæĢś·Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ°²»ÕŹ”Ā®½ĻŲĮłŠ£øßČżÉĻѧʌµŚĖÄ“ĪĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
¹¤ŅµÉĻÓĆĀĮĶĮæó£ØÖ÷ŅŖ³É·ÖĪŖAl2O3£¬Fe2O3µČ£©ĢįČ”Al2O3×öŅ±Į¶ĀĮµÄŌĮĻ£¬ÓÉČŪŃĪµē½ā·Ø»ńµĆµÄ“ÖĀĮÖŠŗ¬Ņ»¶ØĮæµÄ½šŹōÄĘŗĶĒāĘų£¬ÕāŠ©ŌÓÖŹæɲÉÓĆ“µĘų¾«Į¶·Ø³żČ„£¬²śÉśµÄĪ²Ęų¾“¦ĄķŗóæÉÓĆÓŚøֲĶĘĀĮ£®¹¤ŅÕĮ÷³ĢČēĻĀĶ¼ĖłŹ¾£ŗ
£ØŅŃÖŖ£ŗNaClČŪµćĪŖ801”ę£»AlCl3ŌŚ181”ęÉż»Ŗ£©

£Ø1£©øֲĶĘĀĮŗó£¬æ¹øÆŹ“ŠŌÄÜ»į“ó“óŌöĒ棬ĘäŌŅņŹĒ £®
£Ø2£©½«Cl2Į¬ŠųĶØČėŪįŪöÖŠµÄ“ÖĀĮČŪĢ壬ŌÓÖŹĖęĘųÅŻÉĻø”¶ų³żČ„£®ĘųÅŻµÄÖ÷ŅŖ³É·Ö³żCl2Ķā»¹ŗ¬ÓŠ £¬¹ĢĢ¬ŌÓÖŹÕ³ø½ÓŚĘųÅŻÉĻ£¬ŌŚČŪĢå±ķĆęŠĪ³Éø”Ōü£¬ø”ŌüÖŠæĻ¶Ø“ęŌŚ £®
£Ø3£©¾«Į¶Ē°£¬ŠčĒå³żŪįŪö±ķĆęµÄŃõ»ÆĢśŗĶŹÆӢɰ£¬·ĄÖ¹¾«Į¶Ź±ĖüĆĒ·Ö±šÓėĀĮ·¢ÉśÖĆ»»·“Ó¦²śÉśŠĀµÄŌÓÖŹ£¬ŌņĀĮŗĶŃõ»ÆĢś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø4£©ĻņĀĖŅŗÖŠĶØČė¹żĮæCO2Ėł·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £®
£Ø5£©¶ĘĀĮµē½ā³ŲÖŠ£¬½šŹōĀĮĪŖŃō¼«£¬ČŪČŚŃĪµē¶ĘŅŗÖŠĀĮŌŖĖŲÖ÷ŅŖŅŌAlCl4©ŠĪŹ½“ęŌŚ£¬ŌņŃō¼«µÄµē¼«·“Ó¦Ź½ĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģ°²»ÕŹ”Ķī½ĆūŠ£øßČżÉĻѧʌ12ŌĀĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹Ų»ÆѧÓĆÓļ±ķŹ¾ÕżČ·µÄŹĒ
A£®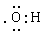 ĪŖōĒ»łµÄµē×ÓŹ½£¬Ņ²ŹĒĒāŃõøłĄė×ӵĵē×ÓŹ½
ĪŖōĒ»łµÄµē×ÓŹ½£¬Ņ²ŹĒĒāŃõøłĄė×ӵĵē×ÓŹ½
B£®S2-µÄ½į¹¹Ź¾ŅāĶ¼£ŗ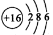
C£®¼×Ķé·Ö×ӵıȥżÄ£ŠĶŹĒ
D£®ÖŠ×ÓŹżĪŖ10µÄŃõŌ×Ó£ŗ18O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016½ģŗÓ±±Ź”ÕżŅæŚŹŠĖÄŠ£øßČżÉĻѧʌĮŖæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ę»¹ūĖįµÄ½į¹¹¼ņŹ½ĪŖ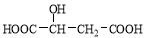 £¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®Ę»¹ūĖįÖŠÄÜ·¢Éśõ„»Æ·“Ó¦µÄ¹ŁÄÜĶÅÓŠ2ÖÖ
B£®1molĘ»¹ūĖįæÉÓė3mol NaOH·¢ÉśÖŠŗĶ·“Ó¦
C£®1molĘ»¹ūĖįÓė×ćĮ潚ŹōNa·“Ӧɜ³ÉÉś³É1mol H2
D£®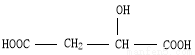 ÓėĘ»¹ūĖį»„ĪŖĶ¬·ÖŅģ¹¹Ģå
ÓėĘ»¹ūĖį»„ĪŖĶ¬·ÖŅģ¹¹Ģå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ°²»ÕŹ”Ī劣øßŅ»ÉĻµŚŅ»“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ£Ø £©
A£®Cl2ĶØČėĖ®ÖŠ£ŗCl2+H2OØT2H++Cl©+ClO©
B£®Ė«ŃõĖ®ÖŠ¼ÓČėĻ”ĮņĖįŗĶKIČÜŅŗ£ŗH2O2+2H++2I©ØTI2+2H2O
C£®ÓĆĶ×÷µē¼«µē½āCuSO4ČÜŅŗ£ŗ2Cu2++2H2O 2Cu+O2”ü+4H+
2Cu+O2ӟ+4H+
D£®Na2S2O3ČÜŅŗÖŠ¼ÓČėĻ”ĮņĖį£ŗ2S2O32©+4H+ØTSO42©+3S”ż+2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2015-2016ѧğ¹ć¶«Ź”ø߶žÉĻŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĪĀ¶ČĪŖTŹ±£»Ļņ2.0 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0 mol PCl5£»·“Ó¦PCl5(g) 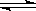 PCl3(g)+Cl2(g)¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
PCl3(g)+Cl2(g)¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0. 19 | 0.20 | 0.20 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®·“Ó¦ŌŚĒ°50 sµÄĘ½¾łĖŁĀŹv(PCl3)=0.0032 mol”¤L-1”¤s-1
B£®±£³ÖĘäĖūĢõ¼ž²»±ä£»ÉżøßĪĀ¶Č£»Ę½ŗāŹ±c(PCl3)=0.11 mol”¤L-1£»Ōņ·“Ó¦µÄ¦¤H<0
C£®ĻąĶ¬ĪĀ¶ČĻĀ£»ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė1.0 mol PCl5”¢0.20 mol PCl3ŗĶ0.20 mol Cl2£»·“Ó¦“ļµ½Ę½ŗāĒ°v(Õż)>v(Äę)
D£®ĻąĶ¬ĪĀ¶ČĻĀ£»ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2.0 mol PCl3ŗĶ2.0 mol Cl2£»“ļµ½Ę½ŗāŹ±£»PCl3µÄ×Ŗ»ÆĀŹŠ”ÓŚ80%
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com