
分析 (1)电负性大于1.8的为非金属元素,小于1.8的为金属元素;
(2)电负性越大,元素原子得电子能力越强;
(3)电负性差值大于1.7的一般形成离子键,小于1.7的为共价键.
解答 解:已知A、B、C、D、E、F六种主族元素,其电负性分别为0.9、2.1、1.2、2.5、1.5、3.0;
(1)电负性大于1.8的为非金属元素,小于1.8的为金属元素,则属于金属元素的是A、C、E;属于非金属元素的是B、D、F;
故答案为:A、C、E;B、D、F;
(2)电负性越大,元素原子得电子能力越强,则得电子能力由强至弱排列的顺序是F>D>B>E>C>A;
故答案为:F>D>B>E>C>A;
(3)电负性差值大于1.7的一般形成离子键,则属于离子化合物的是A3F、EF2,小于1.7的为共价键,属于共价化合物的是D2F2;
故答案为:A3F、EF2;D2F2.
点评 本题考查电负性的应用,侧重考查学生对数据的分析处理与归纳总结能力,注意对元素周期律的理解掌握,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
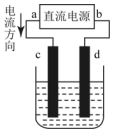
| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
| B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
| D | 升高温度 | 逆反应速率增大量大于 正反应速率增大量 | Z的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论解释 |
| A | 过量铁粉与稀HNO3充分反应后滴入KSCN溶液 | 溶液变红 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质,他们用这种方法清洗一批做了银镜反应实验的试管,配制Fe3+的浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管 | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗干净 | Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 在苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸的酸性比苯酚的强,溶液中还有Na2CO3生成 |
| D | 向硅酸钠溶液中滴入酚酞溶液,再滴加稀盐酸 | 溶液变红,后溶液红色变浅直至消失 | 非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | PH3是非极性分子 | |
| B. | PH3分子中有未成键的电子对 | |
| C. | PH3中的P-H键的极性比NH3中N-H键的极性弱 | |
| D. | PH3分子中的P-H键是非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
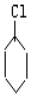 $→_{②}^{NaOH、乙醇}$
$→_{②}^{NaOH、乙醇}$ $→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$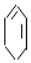

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com