
【题目】高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
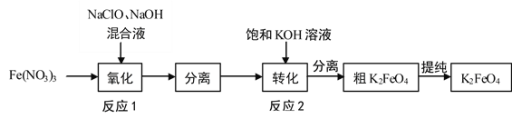
①Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为___(填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是__。
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为___;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为___(保留小数点后1位)。
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为__。电解后,阴极室得到的A溶液中溶质的主要成分为___(填化学式)。
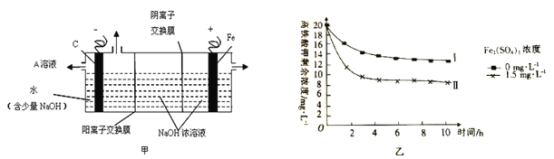
(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是___。
【答案】+6 氧化还原反应 该温度下Na2FeO4的溶解度大于K2FeO4 2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O 55.9g Fe+8OH--6e-=FeO42-+4H2O NaOH Fe2(SO4)3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4的浓度
【解析】
(1)反应1中发生反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,向分离出的Na2FeO4中加入饱和KOH溶液反应生成粗K2FeO4;
(2)Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应生成Na2FeO4,同时生成还原产物NaCl,结合守恒法写出该反应的化学方程式;根据电子守恒计算制备0.5molNa2FeO4消耗NaClO的质量;
(3)电解时,阳极发生氧化反应生成FeO42-,阴极生成氢气和氢氧化钠;
(4)由图可知,Fe2(SO4)3浓度越大,K2FeO4浓度越小,与铁离子的水解有关。
(1)①Na2FeO4中钠元素的化合价为+1价,氧元素的化合价为-2价,根据化合物中元素的正负化合价代数和为0,则铁元素的化合价为0-(-2)×4-(+1)×2=+6价;高铁酸钠中铁元素为+6价,具有强氧化性,能杀菌消毒,故高铁酸钠用于杀菌消毒时的化学反应类型为发生氧化还原反应;
②反应2加入饱和KOH溶液可转化析出K2FeO4,即加入饱和KOH溶液发生的反应为Na2FeO4+2KOH=K2FeO4↓+2NaOH,说明该温度下高铁酸钾的溶解度小于高铁酸钠的溶解度;
(2)Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应生成Na2FeO4,反应中Fe元素的化合价从+3价升高为+6价,Cl元素的化合价从+1价降为-1价,根据得失电子守恒、原子守恒,则该反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;设制备0.5mol的Na2FeO4消耗NaClO的质量为mg,则由电子守恒可知:0.5mol×3=![]() [(+1)-(-1)],解得:m≈55.9;
[(+1)-(-1)],解得:m≈55.9;
(3)根据装置图,Fe为阳极,电解时,阳极发生氧化反应生成FeO42-,电极方程式为Fe-6e-+8OH-=FeO42-+4H2O;阴极电极反应式为2H2O+2e-=H2↑+2OH-,阴极生成氢气和氢氧化钠,则阴极室得到的A溶液中溶质的主要成分为NaOH;
(4)由图可知,Fe2(SO4)3浓度越大,K2FeO4浓度越小,根据“高铁酸盐在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-”,则产生曲线Ⅰ和曲线Ⅱ差异的原因是Fe2(SO4)3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4浓度。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,4条体对角线的1/4处还各有1个碳原子。回答下列问题:

(1)若图中原子1的坐标为![]() ,则原子2的坐标为________。若金刚石的晶胞参数为
,则原子2的坐标为________。若金刚石的晶胞参数为![]() ,则其中碳碳键的键长
,则其中碳碳键的键长![]() ________pm(用含
________pm(用含![]() 的代数式表示)。
的代数式表示)。
(2)面心立方![]() 晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
晶胞与金刚石结构类似,阴、阳离子各占晶胞所含微粒数的一半。
①S元素及其同周期的相邻元素第一电离能由小到大的顺序是________,二氯化硫(![]() )分子中S原子的杂化类型是________。
)分子中S原子的杂化类型是________。
②写出基态![]() 的电子排布式________;把晶胞示意图中表示
的电子排布式________;把晶胞示意图中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③锌锰干电池中![]() 可吸收电池反应产生的
可吸收电池反应产生的![]() 生成
生成![]() ,该离子中含有________个
,该离子中含有________个![]() 键。
键。
④若该![]() 晶胞的晶胞参数为
晶胞的晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)
(列出计算式)
(3)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如有文献报道氨晶体中每个氢原子都形成氢键,则每个![]() 与周围________个
与周围________个![]() 通过氢键相结合。
通过氢键相结合。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。


下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的价电子排布式为___。
(2)磷的一种同素异形体——白磷(P4)的空间构型为___,其键角为__,推测其在CS2中的溶解度___(填“大于”或“小于”)在水中的溶解度。
(3)膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试用价层电子对互斥理论分析PH3的键角小于NH3的原因:___。
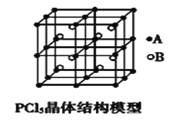
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A、B的化学式分别为___、__,A的中心原子杂化轨道类型为___。
(5)第三周期主族元素中,按第一电离能大小排序,第一电离能在磷和铝之间的元素是__(填元素符号)。
(6)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如下表所示。试从结构的角度分析它们熔点不同的原因:__。
物质 | BN | AlN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
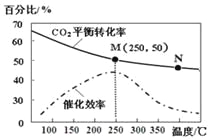
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在1L 0.1mol·L-1NH4Cl溶液中,
(1)水解的离子反应方程式________
(2)溶液中存在的微粒种类:H2O、________
(3)溶液中各种离子浓度从大到小的顺序为:________
(4)溶液中存在的电荷守恒等式 ________
(5)溶液中存在的物料守恒等式 ________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2)∶n(CO)分别为2∶1、5∶2时CO的转化率变化情况(如图1所示),则图中表示n(H2)∶n(CO)=2∶1的变化曲线为________(填“曲线a”或“曲线b”),原因是_________________。

(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 2 mol CO、6 mol H2 | a mol CO、b mol H2、c mol CH3OH(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。

①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com