
【题目】明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)明胶溶于水所形成的分散系和K2SO4溶液共同具备的性质是_______。
a.很稳定,煮沸都无明显变化 b.两者均有丁达尔现象 c.分散质粒子可通过滤纸
(2)现需配制0.5mol·L-1 K2SO4溶液480mL。
①配制溶液时必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、__________、__________、以及等质量的几片滤纸。
②配制该溶液需称取K2SO4固体的质量为_____________
③下列关于容量瓶的使用方法中,正确的是________
A.容量瓶可长期存放溶液 B.在容量瓶中直接溶解固体
C.溶液未经冷却即注入容量瓶中 D.向容量瓶中转移溶液要用玻璃棒引流
④下列操作会使所配溶液浓度偏低的是___________
A.洗净的容量瓶瓶底有少量水 B.称量时药品和砝码放反
C.定容时俯视刻度线 D.移液后烧杯和玻璃棒未洗涤
【答案】C 500ml容量瓶 胶头滴管 43.5g D BD
【解析】
(1)胶体中分散质的粒子直径介于1~100nm,溶液中分散质粒子的直径为小于1nm,胶体具有丁达尔效应;
(2)①配制一定物质的量浓度的溶液所需的容量瓶选择量程是“就近,偏大”原则;
②依据公式c= ![]() 以及
以及![]() 进行计算,溶液体积得用500mL;
进行计算,溶液体积得用500mL;
③根据的结构和用途进行分析;
④一定物质的量浓度的溶液配制中利用公式c= ![]() 进行配制,故从n,V变化的角度入手分析;
进行配制,故从n,V变化的角度入手分析;
(1)胶体受热会发生聚沉,丁达尔效应是胶体所具有的性质,两种分散系都可以通过滤纸,故选C;
(2)①配制480mL溶液依据选用容量瓶的原则选择500mL容量瓶,需要的仪器有托盘天平、药匙、烧杯、玻璃棒、胶头滴管,容量瓶;结合题给信息可知,还缺少的仪器是:500mL容量瓶、胶头滴管;
②依据公式c= ![]() 以及
以及![]() 可得配制500mL所需K2SO4固体的质量=0.5L×0.5mol·L-1 ×174g/mol=43.5g;
可得配制500mL所需K2SO4固体的质量=0.5L×0.5mol·L-1 ×174g/mol=43.5g;
③容量瓶仅作为在一定温度下配制溶液的玻璃仪器,不用于长时间存放溶液,故选择D;
④一定物质的量溶液浓度配制中利用公式c= ![]() ,
,
A.由于容量瓶中有水但是未改变n,V,浓度不会发生变化;
B.选项由于药品和砝码放反,使得所称量药品质量偏小,及n减小,故浓度偏低;
C.定容时俯视刻度线,结果为所加蒸馏水减少即V减小,故c偏高;
D.移液后烧杯和玻璃棒未洗涤,部分溶质粘在烧杯和玻璃棒上造成容量瓶内溶质质量减少即n减小,故c偏低;
故答案选择BD。


科目:高中化学 来源: 题型:
【题目】从古至今化学与生产、生活密切相关。下列说法正确的是( )
A.晶体硅被用于计算机芯片,工业制粗硅的反应原理为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.合金熔点、硬度都低于成分金属
C.中国天眼FAST用到的碳化硅是一种新型的有机高分子材料
D.无色透明的SiO2是制造光导纤维的重要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、科研密切相关,下列有关说法不正确的是( )
A.维生素C能帮助人体将Fe3+转化为易吸收的Fe2+,维生素C具有氧化性
B.“火树银花合,星桥铁索开”,其中的“火树银花”涉及到焰色反应
C.小苏打可以用于制造泡沐灭火器
D.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜制品在潮湿环境中发生的电化学腐蚀过程可表示为如图,腐蚀后有A物质生成,某小组为分析A物质的组成,进行了如下实验:
实验①:取A样品,加过量稀硝酸完全溶解后,再加入![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含![]() 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
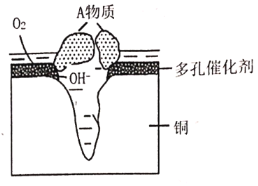
(1)该粉状锈中除了铜元素外还含有(写元素符号)___元素,该铜制品发生电化学腐蚀生成粉状锈时其正极电极反应式为____。
(2)写出该粉状锈溶于稀硫酸反应的离子方程式____。
(3)加热条件下,实验②中所得的黑色固体能与乙醇反应,化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用图甲装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用__(填序号)。
a.碱石灰 b.浓硫酸 c.五氧化二磷 d.氯化钙
(2)若探究氨气的溶解性,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是__。不能在K2的导管末端连接图乙中的__装置(填序号)。
(3)若探究氨气的还原性,需关闭K1、K3,K2连接纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成的气体必须依次通过盛有__试剂和__试剂的洗气瓶。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为__。
③尾气可用C装置处理,若尾气中含有少量Cl2,则C装置中应盛放__溶液(填化学式),反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42- ===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
【答案】D
【解析】A. 氯化铁溶液中的铁离子具有氧化性,能够氧化碘离子,与碘化钾溶液反应的离子方程式为2Fe3++2I-===2Fe2++I2,故A错误;B. 硫酸溶液与氢氧化钡溶液反应生成硫酸钡沉淀和水,离子方程式为Ba2++SO![]() +2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH
+2H++2OH-=2H2O+BaSO4↓,故B错误;C. 醋酸是弱酸,用化学式表示,故C错误;D. 氯化铝溶液与过量氨水反应生成氢氧化铝沉淀,过量的氨水不能溶解氢氧化铝,离子方程式为:Al3++3NH3·H2O===Al(OH)3↓+3NH![]() ,故D正确;故选D。
,故D正确;故选D。
【题型】单选题
【结束】
12
【题目】一定条件下密闭容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),能说明该反应达到化学平衡状态的是( )
2NH3(g),能说明该反应达到化学平衡状态的是( )
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同溶液进行如下实验,其中操作,现象和结论均正确的是( )
选项 | 操 作 | 现 象 | 结 论 |
A | 先向待测液滴加 | 生成白色沉淀,加酸后沉淀不溶解 | 原溶液中有 |
B | 先向待测液滴加2滴 | 先不显红色,再滴新制的氯水后溶液变为红色 | 原溶液中有 |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有 无 |
D | 向待测液滴足量的盐酸 | 将产生的气体通入足量澄清石灰水,溶液变浑浊 | 原溶液中有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型HIN1等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO,1000 mL,密度1.192g/cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)100g某84消毒液与3.55g氯气的氧化能力相当,该产品的有效氯就是3.55%。请问100g某84消毒液中含有___gNaClO。
(2)一瓶“威露士”牌“84消毒液”最多能吸收空气中CO2___L(标准状况)而变质。
(3)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是___(填编号)。
A.如图所示的仪器中,有四种是不需要的,还需两种玻璃仪器
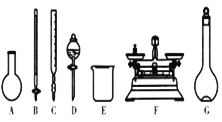
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
(4)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为___g。
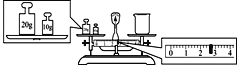
(5)配制一定物质的量浓度的盐酸溶液,下列操作导致所配制的稀盐酸物质的量浓度偏低的是___(填字母)。
A.未恢复到室温就将溶液注入容量瓶并进行定容
B.用量筒量取浓盐酸时俯视凹液面
C.容量瓶用蒸馏水洗后未干燥
D.未洗涤烧杯和玻璃棒
E.定容时仰视液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com