
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1=akJ•mol-1 | 2.5 | 0.2 |
| Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=bkJ•mol-1 | 1.0 | 2.3 |
| Ⅲ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3=ckJ•mol-1 | K3 | 4.6 |
分析 (1)煤的汽化是利用煤与水蒸气反应得到CO与氢气;
(2)①根据反应Ⅰ的化学方程式并结合平衡常数的概念写出K1表达式;
②对于反应Ⅱ来说温度越高平衡常数越大,说明正反应为吸热反应,b>0;反应③=反应①+反应②,则③的焓变=①的焓变+②的焓变;
③反应③=反应①+反应②,则③的平衡常数=①与②的平衡常数的乘积;
计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断正逆反应速率相对大小;
④对于反应Ⅲ在容器容积不变的情况下,欲增加甲醇产率需要通过改变影响平衡的条件,促进平衡正向移动即可;
(3)①应根据乙烯的百分比越大、丙烯的百分比越小选择;
②t0时刻,n(H2O)=3.6mol n(CH2=CH2)=1.8mol,设甲醇起始物质的量为x mol,
2CH3OH(g)?CH2=CH2(g)+2H2O(g)
起始量(mol) x 0 0
变化量(mol) 3.6 1.8 3.6
t0时刻量(mol) x-3.6 1.8 3.6
结合甲烷的体积分数列方程计算解答;
体积增大,压强减小,平衡向右移动,导致生成水的量增大,绘制图象时应注意条件改变瞬间水的物质的量没有立即变化.
解答 解:(1)煤的气化是指煤与水蒸气反应生成CO与H2的过程,反应的化学方程式为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)①根据反应Ⅰ的化学方程式知其平衡常数表达式为K1=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$,故答案为:$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$;
②对于反应Ⅱ来说温度越高平衡常数越大,说明正反应为吸热反应,b>0;反应③=反应①+反应②,则③的焓变=①的焓变+②的焓变,故c=a+b,
故答案为:>;c=a+b;
③反应③=反应①+反应②,则③的平衡常数=①与②的平衡常数的乘积=2.5×1=2.5;
若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10,mol、10mol,产生Qc=$\frac{\frac{10}{2}×\frac{10}{2}}{(\frac{6}{2})^{3}×\frac{2}{2}}$=$\frac{25}{27}$<2.5,故此时反应向正反应进行,则甲醇的生成速率大于其消耗速率;
故答案为:2.5;>;
④反应Ⅲ的△H>0,升高温度和将CH3OH(g)从体系中分离都可使平衡右移,增加甲醇产率,而使用催化剂和恒容条件下通氦气,平衡均不发生移动,不影响甲醇的产率,则选项A、B符合题意,故答案为:A、B;
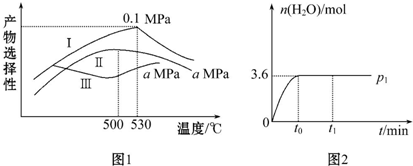
(3)①由图1知,530℃,0.1Mpa时乙烯的选择性最大,为尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa;
故答案为:530℃,0.1Mpa;
②t0时刻,n(H2O)=3.6mol n(CH2=CH2)=1.8mol,设甲醇起始物质的量为x mol,
2CH3OH(g)?CH2=CH2(g)+2H2O(g)
起始量(mol) x 0 0
变化量(mol) 3.6 1.8 3.6
t0时刻量(mol) x-3.6 1.8 3.6
所以$\frac{x-3.6}{x-3.6+1.8+3.6}$=10%,解得x=4.2mol
则甲醇的转化率为$\frac{3.6}{4.2}$×100%=85.7%
若在t1 时刻将容器容积快速扩大到原来的2倍,压强减小,后平衡向右移动,导致生成水的量增大,条件改变后瞬间水的物质的量没有立即变化,变化发生后至反应达到新平衡时水的物质的量与时问的关系图为: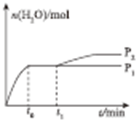 ;
;
故答案为:85.7%; .
.
点评 本题考查化学平衡计算与影响因素、平衡图象、平衡常数、盖斯定律应用等,注意掌握平衡常数的有关应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有浓硫酸参与的反应都是氧化还原反应 | |
| B. | 硫在足量空气中燃烧生成大量SO3 | |
| C. | SO2能使酸性高锰酸钾溶液褪色,体现了漂白性 | |
| D. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL10 mol•L-1的浓盐酸与足量的MnO2反应 | |
| B. | 2molCu与200g98%的浓硫酸反应 | |
| C. | 65gZn与足量的硝酸反应 | |
| D. | H2O(g)和CO2混合气体2mol与足量的Na2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通人H2S,有黄色沉淀 | |
| B. | 加入铜粉,溶液变为蓝色 | |
| C. | 加人锌粉,溶液棕黄色逐渐消失 | |
| D. | 滴加NaHCO3溶液,有气体和红棕色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com