
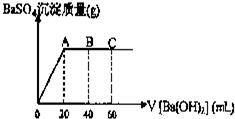
 已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:分析 (1)该温度下,Kw=10-a×10-b=10-(a+b)=10-12,pH=11的Ba(OH)2溶液中c(OH-)=0.1mol/L,c(Ba2+)=$\frac{1}{2}$c(OH-)=0.05mol/L,加入20mLBa(OH)2溶液时,沉淀量达最大,钡离子与硫酸根离子恰好反应,根据n=cV计算该阶段消耗的n(Ba2+),由离子守恒可知n(H2SO4)=n(BaSO4).
加入60mLBa(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,据此计算混合溶液中n(H+),溶液中n(HCl)=n(H+)-2n(H2SO4),再根据c=$\frac{n}{V}$计算原混合溶液中c(HCl);
(2)A点沉淀量达最大,硫酸与氢氧化钡恰好反应,由离子守恒可知n(H2SO4)=n(BaSO4);
(3)根据消耗的氢氧化钡计算B点参加反应的氢离子物质的量,进而计算溶液中氢离子浓度,根据pH=-lgc(H+)计算B点pH值.
解答 解::(1)该温度下,Kw=10-a×10-b=10-(a+b)=10-12,pH=11的Ba(OH)2溶液中c(OH-)=0.1mol/L,c(Ba2+)=$\frac{1}{2}$c(OH-)=0.05mol/L,
加入20mLBa(OH)2溶液时,沉淀量达最大,钡离子与硫酸根离子恰好反应,该阶段消耗的n(Ba2+)=0.02L×0.05mol/L=0.001mol,由离子守恒可知n(H2SO4)=n(BaSO4)=0.001mol,加入60mLBa(OH)2溶液时,溶液的pH=6,呈中性,氢离子与氢氧根离子恰好反应,故混合溶液中n(H+)=n(OH-)=0.06L×0.1mol/L=0.006mol,溶液中n(HCl)=0.006mol-2×0.001mol=0.004mol,
故原混合溶液中c(HCl)=$\frac{0.004mol}{0.02L}$=0.2mol/L,
故答案为:0.2mol/L;
(2)A点沉淀量达最大,硫酸与氢氧化钡恰好反应,由离子守恒可知n(H2SO4)=n(BaSO4)=0.001mol,质量为0.233g;
故答案为:A;0.233;
(3)B点加入的氢氧化钡溶液中氢氧根离子物质的量为0.04L×0.1mol/L=0.004mol,故参加反应的氢离子为=0.004mol,溶液中剩余氢离子为0.006mol-0.004=0.002,氢离子浓度为$\frac{0.002mol}{0.06L}$=$\frac{1}{30}$mol/L,此时溶液pH=-lg$\frac{1}{30}$=1.48,故答案为:1.48.
点评 本题考查混合溶液pH值的有关计算,关键是计算该温度下水的离子积,确定氢氧化钡的溶液中氢氧根离子的浓度,确定C点为中性,难度中等.


科目:高中化学 来源: 题型:解答题
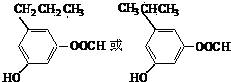
 )分子的一氯代物有2种.
)分子的一氯代物有2种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
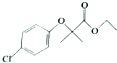 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下: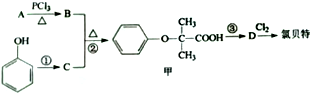

 .
.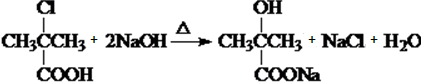 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和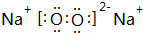 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
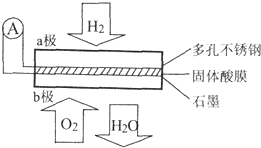 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | H+由b极通过固体酸电解质传递到a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4 mol电子,生成3.6g水 | |
| D. | 电池工作时,化学能主要转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
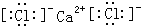 .
. ;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.
;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,3v(N2)正=v(H2)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al<Si | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性:H2SiO3<H2CO3<H3PO4<H2SO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com