

| A. | Ⅰ和Ⅱ | B. | Ⅱ和Ⅲ | C. | Ⅲ和Ⅳ | D. | Ⅰ和Ⅳ |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA | |
| B. | 0.1mol${\;}_{35}^{81}$Br原子中含中子数为3.5NA | |
| C. | 6.0g SiO2晶体中含有的硅氧键数目为0.4NA | |
| D. | 7.8g过氧化钠中所含有的阴离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
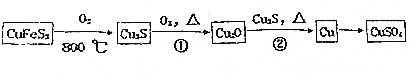
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏水 | B. | 糖水 | C. | 水银 | D. | 水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
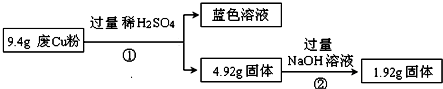

| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com