
| 品名 | 浓缩橙汁 |
| 配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
| 鲜橙原汁含量 | ≥20% |
| 净含量 | 1.5L |
| 生产日期 | 标于瓶盖上 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaCl固体 | B. | 滴加少量硫酸铜溶液 | ||
| C. | 加入少量水 | D. | 加入少量CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入溴水通入澄清石灰水 | |
| B. | 点燃罩上涂有澄清石灰水的烧杯 | |
| C. | 点燃罩上干冷烧杯罩上涂有澄清石灰水的烧杯 | |
| D. | 点燃罩上涂有澄清石灰水的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 氢氧根离子的电子式: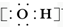 | D. | NH4Br的电子式: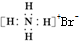 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
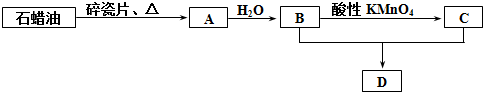
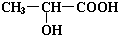 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
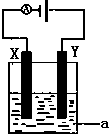
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2mol SO2与足量O2反应可得到2mol SO3 | |
| B. | 含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 | |
| C. | 10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 | |
| D. | 一定条件下,1mol N2与3mol H2反应可制备1.0 mol NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com