
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
分析 A.重水的摩尔质量为20g/mol,重水中含有10个质子,4.0g重水的物质的量为0.2mol,含有2mol质子;
B.气体状况未知;
C.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
D.稀硫酸与铜不反应.
解答 解:A.4.0g重水(D2O)的物质的量为0.2mol,0.2mol重水中含有2mol质子,所含质子数为2NA,故A正确;
B.气体状况未知,Vm不确定,不能使用气体摩尔体积,故B错误;
C.氧气与臭氧都是由氧原子构成,16g的氧气与臭氧混合气体中,氧原子数为$\frac{16g}{16g/mol}$×NA=NA,故C正确;
D.随着反应进行浓硫酸浓度降低,变为稀硫酸,稀硫酸与铜不反应,所以12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数小于0.2NA,故D错误;
故选:AC.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下常见物质的状态及标况下气体摩尔体积的使用条件是解题关键,注意硫酸与铜反应条件,题目难度中等.


科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中含有0.1NA个K+ | |
| C. | 1L溶液中K+浓度为0.2 mol/L | |
| D. | 1L溶液中SO42-的浓度为0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=b时,发生的离子总反应为:2OH-+CO2+Ba2+═BaCO3↓+H2O | |
| B. | 当3a=2b时,发生的离子总反应为:6OH-+3CO2+2Ba2+═2BaCO3↓+3H2O+CO32- | |
| C. | 当$\frac{3}{2}$a<b<3a时,溶液中含有n(CO32-):n(HCO3-)=(3a-b):(2b-3a) | |
| D. | 当3a=b时,溶液中Na+、Ba2+与HCO3-的物质的量之比为1:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存NaClO溶液时加入少量NaOH可以抑制水解 | |
| B. | pH<4时,起漂白作用的Cl2是HClO分解产生的 | |
| C. | 随pH降低,溶液中HClO和Cl2增多,所以漂白速率加快 | |
| D. | 用NaClO溶液漂白色素时,不同条件下由不同成分起到漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
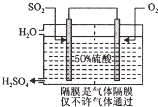 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com