
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |
分析 A.纤维素水解生成葡萄糖,葡萄糖分解生成乙醇;
B.地沟油成分为油脂;
C.白色污染就是一次性难降解的塑料包,灼烧后会导致大气污染;
D.化石燃料燃烧产生大量污染物.
解答 解:A.农作物秸秆主要成分纤维素,纤维素水解生成葡萄糖,葡萄糖分解生成乙醇,故A正确;
B.回收地沟油,制备生物柴油,有利于节约资源,提高资源利用效益,故B正确;
C.焚烧废旧塑料,会导致大气污染,不利于环境保护,故C错误;
D.开发利用各种新能源,减少化石燃料的燃烧,能够减少粉尘、有毒气体的排放,有利于环境保护,故D正确;
故选:C.
点评 本题考查了化学与生产生活的关系,明确相关物质的性质及用途是解题关键,侧重考查环境保护与能源的开发与利用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 用苯萃取碘水中碘后,静置后取出有机层 | 先从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,再继续从分液漏斗下端管口放出上层液体 |
| B | 配制500mL2mol/L的氯化铵溶液 | 用托盘天平称取53.5g氯化铵晶体放入500mL容量瓶,加少量水,振荡后再加水至刻度线 |
| C | 测定氯水的pH | 用玻璃棒蘸取少量溶液滴于pH试纸中央,片刻后与标准比色卡对照 |
| D | 用标准盐酸滴定未知浓度的NaOH溶液(含酚酞) | 左手控制酸式滴定管活塞使液体滴下,右手不断振荡锥形瓶,眼睛要始终观察锥形瓶中溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
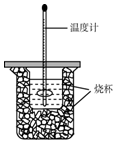 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com