

 ��
�� ��
�� +
+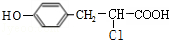 $��_{��}^{����}$
$��_{��}^{����}$ +HCl��
+HCl������ ��H�Ľṹ��ʽ���ƿ�֪GΪ ��B����̼�����Ʒ�Ӧ����B�к���-COOH����B��E�ķ���ʽ��֪��B��HCl�����ӳɷ�Ӧ����E��E����������ˮ��Һ�����������·���±������ˮ�ⷴӦ���кͷ�Ӧ��Ӧ����F����F�ữ�õ�G����BΪ
��B����̼�����Ʒ�Ӧ����B�к���-COOH����B��E�ķ���ʽ��֪��B��HCl�����ӳɷ�Ӧ����E��E����������ˮ��Һ�����������·���±������ˮ�ⷴӦ���кͷ�Ӧ��Ӧ����F����F�ữ�õ�G����BΪ ��EΪ
��EΪ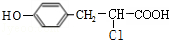 ��FΪ
��FΪ ��B��̼�����Ʒ�Ӧ����CΪ
��B��̼�����Ʒ�Ӧ����CΪ ��C���Ʒ�Ӧ����DΪ
��C���Ʒ�Ӧ����DΪ ��I���Է�������������J��J�ܷ���������Ӧ����IΪCH3CH2OH��JΪCH3CHO���л���A���Ȼ�����Һ������ɫ��Ӧ��������еı�������2��ȡ��������A�ı�����һ�ȴ�����2�֣�A����ˮ�ⷴӦ����B��I����AΪ
��I���Է�������������J��J�ܷ���������Ӧ����IΪCH3CH2OH��JΪCH3CHO���л���A���Ȼ�����Һ������ɫ��Ӧ��������еı�������2��ȡ��������A�ı�����һ�ȴ�����2�֣�A����ˮ�ⷴӦ����B��I����AΪ ���Դ˽����⣮
���Դ˽����⣮
��� �⣺��1�����ݷ�����֪��IΪCH3CH2OH�Ҵ�������Ϊ�Ҵ���JΪ��ȩ��G�������Ӽ�������Ӧ����H��������ӦҲ��ȡ����Ӧ��
�ʴ�Ϊ���Ҵ���ȡ����Ӧ����������Ӧ����
��2�������Ϸ�����֪DΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3��BΪ ��B�Ĺ�������̼̼˫�����ǻ����Ȼ������к���������Ϊ�ǻ����Ȼ���E������������Һ�з�Ӧ����F��������Ӧ������Ϊˮ�ⷴӦ���кͷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��
��B�Ĺ�������̼̼˫�����ǻ����Ȼ������к���������Ϊ�ǻ����Ȼ���E������������Һ�з�Ӧ����F��������Ӧ������Ϊˮ�ⷴӦ���кͷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��
�ʴ�Ϊ���ǻ����Ȼ���
��4����֪��ROH+R1Cl$��_{��}^{����}$ROR1+HCl������ȡ����Ӧ��C��E�����ʵ�����1��1����ڴ��������������·�Ӧ����Ӧ�Ļ�ѧ����ʽΪ�� +
+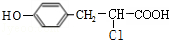 $��_{��}^{����}$
$��_{��}^{����}$ +HCl��
+HCl��
�ʴ�Ϊ�� +
+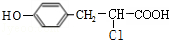 $��_{��}^{����}$
$��_{��}^{����}$ +HCl��
+HCl��
��5��BΪ ��L��B��ͬ���칹�壬����B������ͬ�Ĺ����ţ���L�����ǻ���̼̼˫�����Ȼ��������Ȼ�����Һ������ɫ��Ӧ����L�����к��з��ǻ�����L������ֻ��2��ȡ���������������������-OH��-CH=CHCOOH�������ڡ��䡢�����ֽṹ����ȥB�����⣬����2�ֽṹ��
��L��B��ͬ���칹�壬����B������ͬ�Ĺ����ţ���L�����ǻ���̼̼˫�����Ȼ��������Ȼ�����Һ������ɫ��Ӧ����L�����к��з��ǻ�����L������ֻ��2��ȡ���������������������-OH��-CH=CHCOOH�������ڡ��䡢�����ֽṹ����ȥB�����⣬����2�ֽṹ��
��-OH��-C��COOH��=CH2����3�ֽṹ��
��L����3��ȡ������-OH��-CH=CH2��-COOH����3��ȡ����������λ������3�ֽṹ����3��ȡ�������ڼ�λ������1�ֽṹ��������ȡ�������ڣ���һ��ȡ�����ڼ�λ���λ���ܹ����ڣ�2��3=6�ֽṹ�����Ժ���3��ȡ����ʱ�ܹ����У�3+1+6=10�ֽṹ��
���ݷ�����֪������������ͬ���칹�干�У�2+3+10=15�֣�
�ʴ�Ϊ��15��
���� ���⿼�����л��ƶϣ�Ϊ��Ƶ����ͳ������ͣ�ע�����H�Ľṹ��ʽ�뷴Ӧ������ȡ�����Ʒ����Ͻ����ƶϣ��������չ����ŵ��������ܱ䣬���ؿ���ѧ������������֪ʶǨ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ࡢ��֬�������ʵ�ˮ����ﶼ�Ƿǵ���� | |
| B�� | ���ۺ���ά�صķ���ʽ��Ϊ��C6H10O5��n������Ϊͬ���칹�� | |
| C�� | ��ά�ء����ͷֱ���Ũ�������ʱ��Ũ����ķ�Ӧ����ͬһ���͵ķ�Ӧ | |
| D�� | �Ҵ�������ͱ��ӵķ����о����й�����-OH�����Ծ�����NaOH��Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ��ѧʽ | ������ʼʱ��pH | ������ȫʱ��pH | �й����� |
| Co��OH��2 | 7.2 | 9.4 | Co+2HCl�TCoCl2+H2�� Co2++2NH3•H2O�TCo��OH��2��+2NH4+ Co2++2H2O?Co��OH��2+2H+ Ni+2HCl�TNiCl2+H2�� Ni2++6NH3•H2O�TNi��NH3��6]2++6H2O |
| Fe��OH��2 | 7.1 | 9.6 | |
| Fe��OH��3 | 2.3 | 3.7 | |
| Mg��OH��2 | 10.8 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
�� =O$��_{H+}^{ROH}$
=O$��_{H+}^{ROH}$
 ����Ҫ�����ķ�Ӧ�����Т٢ڢۢܣ���д��ţ����ټӳɷ�Ӧ ����ȥ��Ӧ ��ȡ����Ӧ ��������Ӧ �ݻ�ԭ��Ӧ��д���Ʊ�������
����Ҫ�����ķ�Ӧ�����Т٢ڢۢܣ���д��ţ����ټӳɷ�Ӧ ����ȥ��Ӧ ��ȡ����Ӧ ��������Ӧ �ݻ�ԭ��Ӧ��д���Ʊ�������  �����һ����Ӧ�Ļ�ѧ����ʽ
�����һ����Ӧ�Ļ�ѧ����ʽ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe3+ | Al3+ | ZrO2+ |
| ��ʼ������pH | 1.9 | 3.3 | 6.2 |
| ������ȫ��pH | 3.2 | 5.2 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������ | G�ķ����� | Q�ķ����� |
| �۵�/K | 993 | 1539 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com