
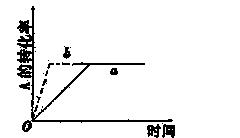
已知某可逆反应在密闭容器中进行:A(g)+2B(g) 3C(g)+D(g)(正反应为放热反应)。下图中曲线a代表一定条件下该反应的过程,若使曲线a变为b曲线,可采取的措施是
( )
A、增大A的浓度 B、缩小容器的体积 C、加入催化剂 D、升高温度
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g)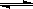 2AB(g)达到平衡的标志是(NA代表阿伏加德
2AB(g)达到平衡的标志是(NA代表阿伏加德
罗常数)
A.单位时间生成NA的A2同时生成NA的AB
B.容器内的总压不随时间变化
C.单位时间生成2NA的AB同时生成NA的B2
D.单位时间生成NA的A2同时生成NA的B2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于溶液物质的量浓度的说法正确的是
A.把1molNaCl溶于1L水中所得溶液的物质的量浓度为1mol/L
B.实验室配制500mL 0.1mol/L的CuSO4溶液,需称取胆矾12.5g
C.1L水中溶解224 L HCl气体(标准状况下测得)后形成溶液物质的量浓度为10 mol·L1
D.将7.4克氢氧化钙放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度线,浓度为1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是 ( )
A.防止硫酸铁分解 B.抑制硫酸铁水解 C.提高硫酸铁的溶解度 D.提高溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
以下各组离子在该溶液中能大量共存的有 ( )
A. 滴加石蕊试液显红色的溶液:Fe3+、NH4+、CO32- 、I-
B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Cl-、Ba2+
D. 所含溶质为Na2CO3的溶液:K+、Na+、NO3-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
)(1)常温下,将0.2 mol/L HCl溶液与0.2 mol/L氨水等体积混合(忽略混合后溶液体积的变化),测得混合后溶液的pH=6,试回答以下问题:
(1)混合后溶液呈酸性的原因是(用离子方程式回答) 。
(2)混合后溶液中由水电离出的c(OH-)为
(3)常温下,将0.2 mol·L-1的盐酸与 0.2mol·L-1的氨水混合,若所得的混合溶液中的pH=7,下列关系正确的是
A、[Cl-]>[NH4+]> [H+] > [OH-] B、[NH4+]>[Cl-]>[OH-]>[H+]
C、[Cl-]=[NH4+]>[H+]=[OH-] D、[NH4+]>[Cl-]>[H+]>[OH-]
(4)由电离常数可知酸性强弱: CH3COOH>H2CO3>HCO3-,则浓度相同的下列溶液碱性由强到弱顺序为: (填序号)
①CH3COONa ② NaHCO3 ③ Na2CO3
(5)将氯化铁溶液蒸干、灼烧,最后得到的固体是 。
(6)Cu(OH)2(s) 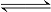 Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol•L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
Cu2+(aq)+2OH-(aq),在常温下Ksp( Cu(OH)2)=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02 mol•L-1的CuSO4溶液中加入NaOH溶液,调整pH最小到 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+)=2 mol·L-1,c(SO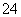 )=6.5 mol·L-1,若将
)=6.5 mol·L-1,若将
200 mL此混合液中的Mg2+和Al3+ 分离,至少应加入1.6 mol·L-1的苛性钠溶液( )
A.0.5 L B.1.625 L C.1.8 L D.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量Fe、Fe2O3的混合物中加入250 mL 2 mol·L-1的HNO3溶液,反应完成后生成1.12 L(标准状况下)NO气体,再向反应后溶液中加入1 mol·L-1 NaOH溶液,要使铁元素完全沉淀下来,所加入NaOH溶液体积最少是 ( )。
A.450 mL B.500 mL
C.400 mL D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
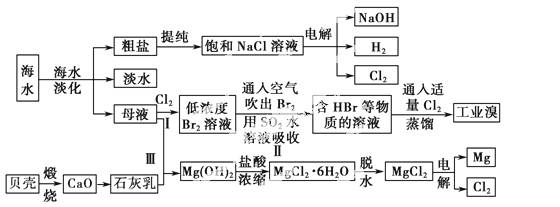
(1)在粗盐中含有Ca2+、Mg2+、SO等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是____________(填编号)。
(2)工业上电解饱和食盐水的离子方程式:_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是____________ _____。
_____。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_____________________。
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入________溶液,充分搅拌后经________(填操作方法)可得纯 净的Mg(OH)2。
净的Mg(OH)2。
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2·6H2O的原因:______________________。
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填序号)。
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com