

分析 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO4•5H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,由此可得.
解答 解:稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO4•5H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,
(1)硝酸根离子在酸性条件下有强氧化性,将铜氧化为铜离子,自身被还原为低价的氧化物,反应为:Cu+4H++2NO3-?Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-?3Cu2++2NO↑+4H2O;Au、Pt与酸不反应,则为滤渣1的主要成分;
故答案为:Cu+4H++2NO3-?Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-?3Cu2++2NO↑+4H2O;Au、Pt;
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+,调溶液PH的目的是使Fe3+和Al3+形成沉淀;
故答案为:把Fe2+氧化为Fe3+;Fe3+和Al3+;
(3)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙最合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,所以上述三种方案中:甲方案制得的硫酸铝晶体中混有大量硫酸铁杂质,不可行;
故答案为:甲;甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质.
点评 本题考查物质的制备实验,为高频考点,把握制备实验流程及物质组成、性质、发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、NO3-、AlO2-、Na+ | B. | NH4+、SO42-、CO32-、NO3- | ||
| C. | Mg2+、Fe3+、Cl-、SCN- | D. | K+、Ca+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液稀释至10倍后pH=4 | |
| C. | 0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积混合后pH=1.5 | |
| D. | 若向氨水中加入等浓度稀盐酸至溶液正好呈中性,则所用稀盐酸的体积一定小于氨水的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4溶液与BaCl2溶液 | B. | NaOH溶液和稀H2SO4溶液 | ||
| C. | NaCl溶液与KNO3溶液 | D. | Na2CO3溶液与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
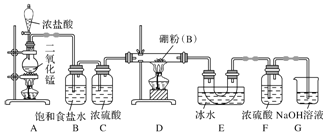
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值) | |
| B. | 放电时,负极反应式为Al+7[AlCl4]--3e-=4[Al2Cl7]- | |
| C. | 充电时,阴极反应式为Cn[AlCl4]+e-=[AlCl4]-+Cn | |
| D. | 充、放电过程中,R+的移动方向相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,反应类型:消去反应;
,反应类型:消去反应;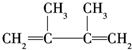 +Br2→CH2BrCBr(CH3)(CH3)C=CH2,反应类型:加成反应.
+Br2→CH2BrCBr(CH3)(CH3)C=CH2,反应类型:加成反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com