
下列是反应2A + 3B = C + 4D在不同时刻测得的速率,其中最快的是
A.V(A)=0.6mol/L.s B.V(B)=0.9mol/L.s
C.V(C)=0.4mol/L.s D.V(D)=1.0mol/L.s
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
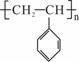 聚苯乙烯的结构为 ,试回答下列问题:
聚苯乙烯的结构为 ,试回答下列问题:
(1)聚苯乙烯的链节是_________________,单体是___________________;
(2)实验测得聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为__________ ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH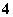 和H3O+ ③NH3和H3O+ ④O3和SO2
和H3O+ ③NH3和H3O+ ④O3和SO2
⑤CO2和C2H2 ⑥SiO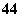 和SO
和SO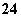
A.全部 B.除①④⑥以外 C.③④⑤⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
⑴A基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
⑵某同学根据上述信息,所画的B电子排布图如图 ,违背了 原理。
,违背了 原理。
⑶F位于 族 区,其基态原子有 种运动状态。
⑷CD3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其分子空间构型为 ,检验E元素的方法是 。
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
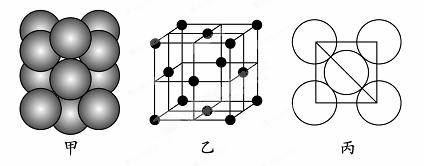
查看答案和解析>>
科目:高中化学 来源: 题型:
锂~碘电池可用来为心脏起搏器提供能源,其电池反应可简化为:2Li + I2 = 2LiI。下列有关说法正确的是
A.I2发生氧化反应 B.碘电极为该电池的正极
C.正极反应为:Li – 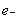 = Li+ D.该电池放电时化学能转化为电能
= Li+ D.该电池放电时化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
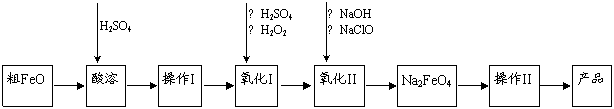
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
① Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.② ③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是 ( )
A.IA族与ⅦA族元素间可形成共价化合物或离子化合物
B.第二周期元素从左到右,最高正价从+1递增到+7
C.同主族元素的简单阴离子还原性越强,对应单质的氧化性也越强
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com