
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸( 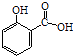 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时: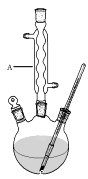
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是 , 加入沸石的作用是。若加热后发现未加沸石,应采取的正确方法是。
(2)制备水杨酸甲酯时,最合适的加热方法是。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是。
(4)反应结束后,分离出甲醇采用的方法是。
(5)实验中加入无水硫酸镁的作用是。本实验的产率为(保留两位有效数字)。
【答案】
(1)温度计;防止暴沸;停止加热,待冷却后加入
(2)水浴加热
(3)加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率
(4)蒸馏或水洗分液
(5)除水或干燥;60%;
【解析】(1)由装置中仪器A的构造可知,仪器A的名称是球形冷凝管,使挥发出来的气体冷凝回流;给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应冷却后补加;
(2)控制温度在85~95℃下恒温下加热反应,温度低于100℃,应采取水浴加热;
(3)该实验中加入甲苯,易将水蒸出,反应产生的水从反应体系中分离开来,使得平衡向右移动,水在低温下挥发,同时减少了甲醇的消耗,从而提高反应的产率;
(4)甲醇和水杨酸甲酯是互溶的液体,可用蒸馏来分离;甲醇易溶于水,水杨酸甲酯不溶于水,可以水洗来分离;
(5)MgSO4固体吸收粗酯中有水分,所以验中加入无水硫酸镁的作用是除水或干燥,水杨酸和甲醇的物质的量分别为:0.1mol,0.75mol,由于水杨酸和甲醇是按照1:1进行反应,所以甲醇过量,生成水杨酸甲酯的量要按照水杨酸的物质的量计算,即理论上生成0.1mol水杨酸甲酯;实际上生成的水杨酸甲酯的质量为9.12g,物质的量为: ![]() =0.06mol,所以实验中水杨酸甲酯的产率
=0.06mol,所以实验中水杨酸甲酯的产率 ![]() ×100%=60%;
×100%=60%;
故答案为:(1)球形冷凝管;防止暴沸;停止加热,待冷却后加入;(2)水浴加热;(3)加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率;(4)蒸馏(或水洗分液);(5)除水或干燥;60%。
(1)根据蒸馏装置、操作分析;
(2)酯化反应需要加热,但温度过高易造成甲醇挥发;
(3)结合平衡移动分析;
(4)水杨酸甲酯不溶于水,甲醇可溶于水,可用水洗分液分离;
(5)无水硫酸镁具有干燥吸水作用;有机物制备过程常伴随有副反应的发生,其产率等于实际产量除以理论产量;理论产量可由化学方程式求得。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
A.用图1所示装置制取少量H2
B.用图2所示装置吸收氨气以防止倒吸
C.用图3所示装置验证Na和水反应的热效应
D.用图4所示装置可用于干燥、收集氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是________________________________________________________________________。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:_____________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(4)实验室溶解该熔融物,最好选用下列试剂中的____(填字母),理由是__________。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业生产中所用的α—Fe催化剂的成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时混合物中铁的质量分数约为
A.70.0% B.77.8% C.72.4% D.75.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的说法正确的是
A.硫酸钠溶液能导电,所以它是电解质B.电解质在熔融状态下都能导电
C.水溶液能导电的化合物不一定是电解质D.难溶物质肯定不是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的原因是 ( )
①用量筒取浓硫酸时,俯视读数;②量筒中浓硫酸全部转移到烧杯中稀释,再转移到100mL容量瓶中,烧杯未洗涤;③用玻璃棒引流将烧杯中溶液转移至容量瓶中,有溶液流到了容量瓶外面;④用胶头滴管加蒸馏水时,不是逐滴加入,因而使液面超过了刻度线,他立即用滴管吸去多余的水,使溶液凹面刚好和刻度线相切。
A. ②③④ B. ③④
C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,1mol Al与足量HCl溶液反应失去的电子数为3NA
B. 标准状况下,11.2L H2O所含的分子数为0.5NA
C. 0.1molNa+所含的电子数为1.1NA
D. 通常状况下,NA 个CO2分子占有的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,10mL 0.1molL﹣1 的一元酸HA溶液,在水中约有0.1%发生电离(每1000个HA只有1个HA电离),下列叙述不正确的是( )
A.该溶液的pH约是4
B.HA一定是一种弱酸
C.恰好中和时消耗NaOH的物质的量是10﹣6mol
D.与足量Mg完全反应生成标准状况下气体的体积可能是11.2 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com