


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、0.1 mol/(L?S) |
| B、0.05mol/( L?min) |
| C、0.05mol/(L?s) |
| D、0.8mol/(L?S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
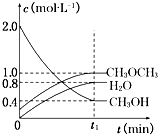 (1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)?N2O3(g),其平衡常数表达式为K=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
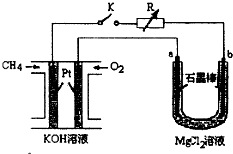 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 CH4和 O2,电解质为 KOH 溶液.某研究小组将甲烷燃料电 池作为电源进行氯化镁溶液龟解实验,电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
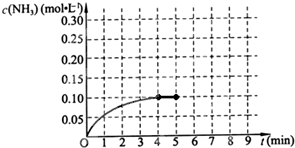 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g);△H<0,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH- |
| B、钢铁发生电化学腐蚀的负极反应式:Fe一3e-=Fe3+ |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+ |
| D、Pt电极电解饱和食盐水时,阳极的电极反应式为:2Cl-一2e-=Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com