
分析 (1)30.00mL 5.00mol•L-1的稀硫酸如果溶解的全部是碳酸镁,则其质量为最少,根据硫酸与碳酸镁反应的方程式可计算出原料的质量;
(2)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,据此书写离子方程式;
(3)根据Ksp[Mg(OH)2]可计算出镁离子开始出现沉淀时的pH值,根据Ksp[Fe(OH)3]可计算出铁离子沉淀完全时的pH值,据此判断溶液的pH值范围;
(4)在pH在9~10之间溶液A中,可以通过锌离子的物质的量计算出剩余EDTA的物质的量,调节pH在5~6时,通过锌离子的物质的量可计算出总EDTA的物质的量,由此可计算出与镁离子反应的EDTA的物质的量,根据$\frac{镁离子的质量}{样品的质量}$×100%计算出Mg2+的质量分数;
解答 解:(1)30.00mL 5.00mol•L-1的稀硫酸的物质的量为0.15mol,根据硫酸与碳酸镁反应的方程式可知碳酸镁的物质的量也为0.15mol,所以碳酸镁的质量为0.15mol×84g/mol=12.60g,
故答案为:12.60g;
(2)加入H2O2的目的是将溶液中的亚铁离子氧化成铁离子再调节pH值,将铁元素除去,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根据Ksp[Mg(OH)2]可知镁离子开始出现沉淀时溶液中氢氧根离子的浓度为$\sqrt{\frac{1.0×10{\;}^{-12}}{0.01}}$mol•L-1=1×10-5 mol•L-1,此时溶液的pH值为9,根据Ksp[Fe(OH)3]可知铁离子沉淀完全时溶液中氢氧根离子的浓度为$\root{3}{\frac{1.0×10{\;}^{-39}}{1×10{\;}^{-6}}}$mol•L-1=1×10-11mol•L-1,此时溶液的pH值为3,所以需调节溶液pH范围为3~9,
故答案为:3~9;
(4)Mg2+、Zn2+与EDTA均按1:1反应,在25mL溶液A中:n(EDTA)=n(Zn2+)=0.10×20.00×10-3=2.00×10-3mol
则100mL溶液A中剩余EDTA的量:n(EDTA)=2.00×10-3×100/25=8.00×10-3mol
25mL溶液A中EDTA的量:n(EDTA)总=n(Zn2+)=0.10×30.00×10-3=3.00×10-3mol
则100mL溶液A中EDTA总量:n(EDTA)总=3.00×10-3×4=0.0120mol
所以与1.5g样品中镁离子反应的EDTA的物质的量为0.012mol-8.00×10-3 mol=0.004mol,所以样品中n(Mg2+)=0.004mol,其质量为0.004mol×24g/mol=0.096g,
则该结晶硫酸镁中Mg2+的质量分数为$\frac{0.096g}{1.5g}$=6.4%,
故答案为:6.4%.
点评 本题考查了物质的制备、分离提纯实验方案的设计,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与实验能力、以及计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 减少氮氧化物的排放 | B. | 降低对臭氧层的破坏 | ||
| C. | 减少二氧化碳的排放 | D. | 防止温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ① | C. | ③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.6mol/L | C. | 0.9 mol/L | D. | 1.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
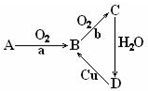

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
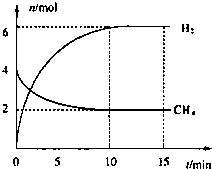 碱金属元素的单质及其化合物被广泛应用于生产、生活中.
碱金属元素的单质及其化合物被广泛应用于生产、生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
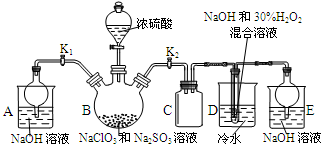 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
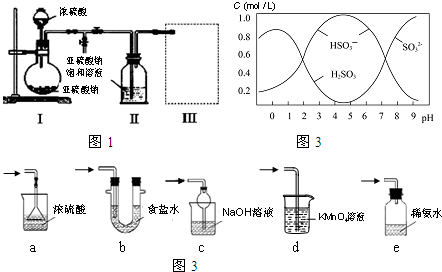
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、SO42-、K+ | B. | K+、OH-、CO32-、Na+ | ||
| C. | HCO3-、OH-、Cl-、Na+ | D. | Ag+、NO3-、Cl-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com