
| A. | 347kJ/mol | B. | 368 kJ/mol | C. | 386 kJ/mol | D. | 414 kJ/mol |
分析 丙烷分子中含有2个C-C键和8个C-H键,新戊烷分子中含有4个C-C键和12个C-H键,设出C-H键的平均键能为x、C-C的平均键键能为y,分别根据丙烷、新戊烷中断裂键能的数据列式计算.
解答 解:C-H键的平均键能为x、C-C的平均键键能为y,
丙烷分子中含有2个C-C键和8个C-H键,则:①8x+2y=4006,
新戊烷分子中含有4个C-C键和12个C-H键,则:②12x+4y=6356,
联立①②解得:x=414kJ/mol、y=347kJ/mol,
即:C-C键的平均键能为347kJ/mol,
故选A.
点评 本题考查了化学键键能的计算,题目难度不大,明确丙烷、新戊烷分子中含有碳碳键、碳氢键数目为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 硫化钠溶液呈碱性的原因:S2-+2H2O=H2S+2OH- | |
| C. | 向碳酸钠溶液中通入少量的二氧化硫:2SO2+CO32-+H2O=2HSO3-+CO2↑ | |
| D. | 氧化亚铁溶于稀硝酸中:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molCl2与足量Fe反应转移电子数一定为3NA | |
| B. | 1mol SiO2晶体中含NA个SiO2分子 | |
| C. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配制溶液时,必须先用该溶液润洗 | |
| B. | 在蒸馏实验时常加入碎瓷片以防止暴沸 | |
| C. | 可用碱式滴定管量取20.00mLKMnO4溶液 | |
| D. | 分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精可以提取某些花香中的酯类香精,制成香水 | |
| B. | 炒菜时加一些料酒和食醋,使菜更香 | |
| C. | 用热水洗涤碗筷去油腻比冷水效果好 | |
| D. | 各种水果有不同的香味,是因为含有不同的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
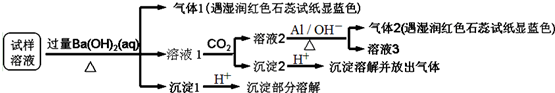
| A. | 试样中肯定存在NH4+、SO42-和NO3-,可能有Mg2+ | |
| B. | 试样中不一定存在Na+、Cl-、HCO3- | |
| C. | 沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝 | |
| D. | 该雾霾中可能存在NaNO3、NH4HCO3和MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O=H2↑+Cl2↑+2OH- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com