
【题目】下列说法正确的是
A. 煤和石油都是可再生资源 B. 分离煤焦油可以获取苯
C. 石油的裂化仅能得到烷烃 D. 煤的气化和石油的分馏都属于物理变化
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B. 在燃煤中加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
C. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
D. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验原理或操作的叙述中,正确的是( )
A.振荡分液漏斗后,应立即将漏斗放在铁架台的铁圈上静置
B.硝酸钾中含有少量氯化钠可用重结晶的方法提纯
C.点样后应在滤纸上形成一个直径较大的样斑,以便实验时观察
D.若不慎将液溴溅到手上,可立即用大量氢氧化钠溶液清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色的化学
B.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
C.电镀时,将镀件作为阳极
D.瑞典化学家贝采利乌斯最早提出了有机化学的概念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素在电子、材料等领域应用广泛。回答下列问题:

(1)基态铜的晶胞如图。它的空间利用率为____________,原子分数坐标a为(0,0,0);d为(1/2,1/2,0)。则e处的分数坐标为____________________。
(2)氧化亚铜为半导体材料,晶胞结构如图,晶胞中有_________个氧化亚铜,该晶胞的边长为a pm,则此种氧化物的密度为_________g·cm-3(用NA表示阿伏加德罗常数的值)。
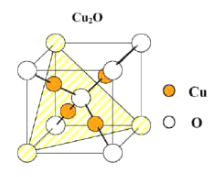
(3)向[Cu(NH3)4]SO4溶液通入适量SO2至微酸性,溶液蓝色褪去,铜离子被还原,产生白色沉淀(含有一种三角锥形阴离子和一种正四面体阳离子),化学反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
(1)实验原理。
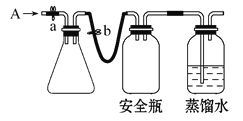
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为____________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2Na2S2O32NaI+Na2S4O6。
(2)实验步骤。
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是_________;
②用注射器抽取某水样20.00 mL从A处注入锥形瓶;
③再分别从A处注入含mmol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及一定浓度的硫酸(含H2SO4nmol);
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂;
⑧用0.005 mol·L-1Na2S2O3溶液滴定至终点。滴定终点的现象是_____________。
(3)数据分析。
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将__________(填“偏大”“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )
![]()
A. 若A为非金属单质,则D一定为硝酸或硫酸
B. 若A为金属单质,则组成A的元素一定位于第三周期第IA族
C. 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下能使铁和铝发生钝化
D. 若A是共价化含物,A的水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是我国大部分地区雾霾天气产生的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。SO2主要来自于汽车尾气、燃煤烟气、硫酸工业尾气、冶金工业烟气等。
(1)“催化转换器”能将汽车尾气中CO与NO转化成可参与大气生态环境循环的无毒气体,并促进烃类充分燃烧及SO2的转化,但也在一定程度上提高了空气的酸度。“催化转换器”提高空气酸度的原因是_____________________________。
(2)用氨水将燃煤烟气中的SO2转化成NH4HSO3。该法是利用了SO2________(填选项字母编号)
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物性质
(3)用生物质热解气(主要成分CO、CH4、H2)将燃煤烟气中SO2在高温下还原成单质硫。主要发生了下列反应:
2H2(g) +SO2(g)= S(g) + 2H2O(g) △H1 = + 90.4kJmol-1
2CO(g) +O2(g)= 2CO2(g) △H2 = - 566.0kJmol-1
S(g) +O2(g)= SO2(g) △H3 = - 574.0kJmol-1
试写出CO将SO2还原成S(g)的热化学方程式__________________________。
(4)将硫酸工业尾气中的SO2转化成硫酸,同时获得电能。装置如图所示(电极均为惰性材料):
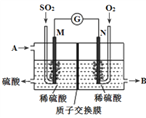
①溶液中的H+移向_______。(填“M”或“N”)
②M极发生的电极反应式为________________。
③写出A、B所代表的物质的化学式:
A_______、B ________。
(5)利用硫酸钠溶液吸收冶金工业烟气中SO2,再用惰性电极电解,能获得所需的产品,装置如图所示。

①若电解后A极区得到硫酸,则B电极反应式为________________________。
②若电解后A极区析出硫磺,则电解反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com