
【题目】化学物质及其变化与人类生产、生活密切相关,请填写下列空格:
(1)现有水、氮气、氧气、铁四中物质,其中:(填写化学式)
①可供给人类呼吸的是______.
②可作溶剂,对生命活动具有重要作用的是______.
③可用于食品防腐的是______.④应用最广泛的金属是______.
(2)用化学方程式表示:
①水在通电作用下的反应:_______②细铁丝在氧气中燃烧的反应:______.
③实验室制取二氧化碳的反应:______.
科目:高中化学 来源: 题型:
【题目】促进生态文明,保护生态环境,是实现“中国梦”的重要组成部分。
(1)天然水中杂质较多,常需加入明矾、漂白粉等物质处理后才能饮用。加入明矾的作用是________;漂白粉能杀菌消毒是因为漂白粉使蛋白质发生________。
(2)处理废水中重金属铊(TI),需在废水中加入NaClO,作________(填“氧化剂”或“还原剂”),将TI+转变为TI3+;再加入氨水,将TI3+转变为难溶物TI(OH)3,写出生成TI(OH)3,的离子方程式:________。该方法处理后的废水中因含有大量的________元素(填写元素名称),直接排放易导致水体富营养化。
(3)聚乙烯塑料常用于食品包装,随便丢弃会造成白色污染。聚乙烯的结构简式是________,聚乙烯塑料属于________(填“热固性”或“热塑性”)塑料。
(4)空气污染指数是根据空气中________、二氧化氮和可吸入颗粒等污染物的浓度计算出来的数值。大气污染的危害是多方面的,如形成酸雨,除雨是指pH小于________的降水。
(5)用氧缺位铁酸铜(CuFe2O4-x)作催化剂,利用太阳能热化学循环分解H2O可制H2,其物质转化如图所示。写出其中氧缺位铁酸铜(CuFe2O4-x)与水反应的化学方程式:________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中化合物做还原剂的是
A. Br2+2NaI= 2NaBr+ I2 B. Zn+ H2SO4= ZnSO4+H2↑
C. 3C+CaO![]() CaC2+CO↑ D. 2Al+ Fe2O3
CaC2+CO↑ D. 2Al+ Fe2O3![]() 2Fe+ Al2O3
2Fe+ Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。请完成以下有关物质结构的问题:
(1)写出Fe2+的最高能层的电子排布式:________________。
(2)[Cr(H2O)4Cl2] Cl·2H2O中Cr 的配位数为________________;
已知CrO5中Cr为+6价,则CrO5的结构式为________。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型为_______;己知该物质的中心原子价电子数与配体提供电子总数之和为18,则n=__________;与Ni(CO)n中配体互为等电子体的阴离子化学式为________________。
(4)金刚砂(SiC)结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得到金刚砂(SiC)结构。SiC是_________晶体,键角是_________;在SiC中,如果以一个硅原子为中心,则与硅原子次近的第二层有________个硅原子。
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。CuH的晶体结构如下图所示,若CuH的密度为d g ·cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为______cm(用含d和Na的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在做完碳还原氧化铜试验后,进行了如图的探究
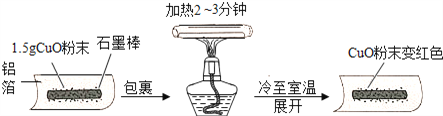
【猜想】把氧化铜还原成铜的物质是:Ⅰ石墨;Ⅱ___________.
【实验】用天平称量1.5g氧化铜粉末,直接用铝箔纸包裹.按上述操作步骤实验,黑色粉末___________,那么猜想Ⅱ不成立.
【实验】石墨棒能使氧化铜还原成铜,该反应的化学方程式为____________
【改进】把石墨棒换成铝粉重复上述操作,又获成功.那么称取等量的铝粉并进行同样的操作,其目的是___________.改进后的实验证明,金属铝与铜活动顺序是___________,该反应的化学方程式为_______________________
【拓展】如果使用复印机的“碳粉”代替石墨棒还原氧化铜,效果更好.联想在空气中灼烧的铁丝不能燃烧,而铁粉能燃烧,其原因是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A. AgCl固体在等物质的量浓度的NaCl、MgCl2溶液中的溶度积相同
B. 在0.1mol/L的NaOH溶液中,由水电离出的c(H+)>![]()
C. 将NH4Cl溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
D. CH3COONa和盐酸两溶液混合后,呈中性的混合溶液中:c(Na+)=c(Cl-)>c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写化学方程式:
(1)一种单质还原一种化合物_____________________________________
(2)一种单质氧化另一种单质_________________________________________
(3)一种非金属单质还原一种氧化物________________________________________
(4)同一物质中一种元素氧化另一种元素______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年华北地区频繁的雾霾天气已经引起人们的高度重视,化学反应原理可用于治理环境污染,请回答下列问题:
(1)一定条件下,可以用CO处理燃煤烟气生成液态硫,实现硫的回收。
①已知:2CO(g)+O2(g) = 2CO2(g) ΔH= -566 kJ·mol-1
S(l) +O2(g) = SO2(g) ΔH=-296 kJ·mol-1
则用CO处理燃煤烟气的热化学方程式是_____________________。
②在一定温度下,在2 L密闭容器中投入2 mol CO、l mol SO2发生上述反应,达到化学平衡时SO2的转化率为90%,则该温度下该反应的平衡常数K的数值为____________。
(2)SNCR—SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
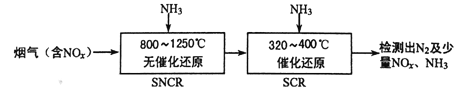
已知该方法中主要反应的热化学方程式:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
a. 4v逆(N2) = v正(O2)
b.混合气体的密度保持不变
c. c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂4 mol N-H键的同时断裂4 mol![]() 键
键
(3)如图所示,反应温度会直接影响SNCR技术的脱硝效率。
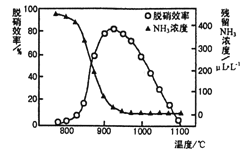
①SNCR技术脱硝的最佳温度选择925 ℃的理由是_____________。
②SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是__________________。
(4)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示:
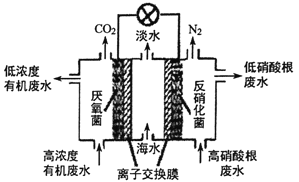
①中间室的Cl-移向_________(填“左室”或“右室”),处理后的含硝酸根废水的pH__________(填“降低”或“升高”)
②若图中有机废水中有机物用C6H12O6表示, 请写出左室发生反应的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同
B. 不能用澄清石灰水鉴别SO2和CO2
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com