
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
分析 ①根据n=$\frac{m}{M}$计算出钠离子的物质的量,再根据硫酸钠的化学式组成得出硫酸钠的物质的量,最后根据c=$\frac{n}{V}$可计算出该溶液浓度;
②题中缺少溶液密度,无法计算溶液体积,则无法计算该溶液浓度
③浓度为18.4 mol•L的硫酸10 mL加到100 mL水中所得的稀硫酸,无法计算溶液体积;
④根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,从而可得出溶液质量,再根据V=$\frac{m}{ρ}$计算出溶液体积,最后根据c=$\frac{n}{V}$可计算出该溶液浓度.
解答 解:①每10mL溶液中含有0.23gNa+的硫酸钠溶液,根据n=$\frac{m}{M}$计算出钠离子的物质的量,再根据硫酸钠的化学式组成得出硫酸钠的物质的量,最后根据c=$\frac{n}{V}$可计算出该溶液浓度,故①正确;
②每10个水分子中溶有1个Na+的NaOH溶液,缺少溶液密度,无法计算溶液体积,则无法计算该溶液浓度,故②错误;
③题中数据无法计算稀释后溶液的体积,则无法计算稀释后溶液浓度,故③错误;
④标准状况下,100 mL氨气溶于20mL水中所得溶液的密度为0.9 g•cm 3的氨水,可以先根据n=$\frac{V}{{V}_{m}}$计算出氨气的物质的量,20mL水的质量约为20g,从而可得出溶液质量,再根据V=$\frac{m}{ρ}$计算出溶液体积,最后根据c=$\frac{n}{V}$可计算出该溶液浓度,故④正确;
故选C.
点评 本题考查了物质的量浓度的计算及其判断,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.
,E原子的价电子排布式为3s23p5,F在周期表中的位置是第四周期第IVB族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
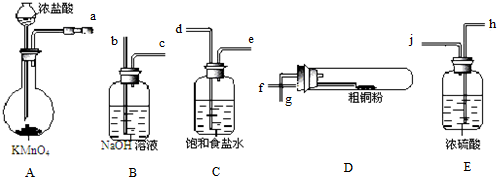

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
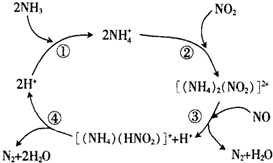 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
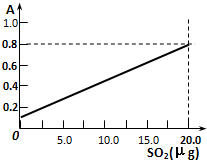 某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题:
某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com