
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
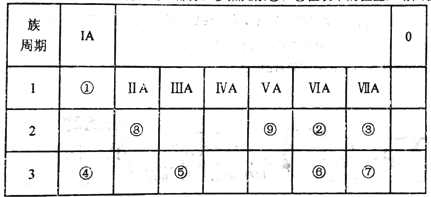
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
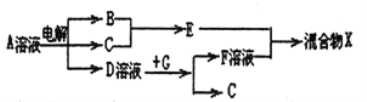
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
【答案】 Na>Cl>F AC H2O2+2Fe2++2H+=2Fe3++2H2O Be(OH)2+2NaOH=Na2BeO2+2H2O NH4++OH-![]() NH3↑+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成
NH3↑+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成
【解析】试题分析:根据元素周期表,①是H元素;②是O元素;③是F元素;④是Na元素;⑤是Al元素;⑥是S元素;⑦是Cl元素;⑧是Be元素;⑨是N元素。
解析:(1)同周期元素从左到右半径减小,所以Na>Cl;同主族元素从上到下半径增大,所以Cl>F,故半径Na>Cl>F;(2)A.氧气与H2S溶液反应生成单质硫,溶液变浑浊,说明氧气的氧化性大于S,能证明O元素的非金属性比S元素的非金属性强,故A正确;氧化性强弱与得失电子难易有关,与得失电子多少无关,故B错误;H2O的分解温度大于H2S,说明H2O的热稳定性大于H2S,能证明O元素的非金属性比S元素的非金属性强,故C正确;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物是H2O2,在酸性溶液中H2O2能将Fe2+氧化为Fe3+,该反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)根据氢氧化铝与氢氧化钠反应的方程式,Be(OH)2与NaOH反应生成Na2BeO2,反应化学方程式是Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5)已知W+X=Y+Z(反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),则W、X、Y、Z分别是NH4+、OH-、NH3、H2O,该化学方程式是NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(6)B为黄绿色气体,B是氯气,已知电解饱和食盐水可生成氢气、氯气、氢氧化钠,D溶液显碱性,所以D是氢氧化钠,A是氯化钠;单质G能与氢氧化钠溶液反应生成氢气,所以G是铝;F是偏铝酸钠;①氢氧化钠溶液与铝反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;②A是氯化钠溶液,检验氯离子的方法是取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液,若有白色沉淀生成,则含有氯离子。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】日照市是山东半岛蓝色经济区的重要组成部分,对海洋资源的开发受到高度重视,下列说法正确的是
A.Mg和U都属于海水中的微量元素
B.可以利用太阳能将海水蒸馏淡化生产饮用水
C.从海水中提取溴的过程不涉及氧化还原反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( ) 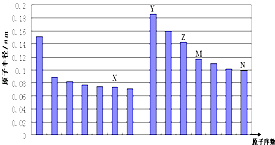
A.N、Z两种元素的离子半径相比前者较大
B.M、N两种元素的气态氢化物的稳定性相比后者较强
C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应
D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与对应化学(或离子)方程式都正确的是( )
A.金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═Na++OH﹣+H2↑
B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl
C.铜与稀硝酸反应:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4gNaOH和0.1mol Na2CO3混合并配成溶液,向溶液中滴加1.0molL﹣1稀盐酸.下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
B.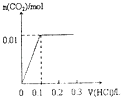
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生反应(填“氧化”或“还原”);溶液中的H+移向(填“正极”或“负极”).若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质变质量为47g,试计算产生氢气的体积(标准状况) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法的原理为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,2NaHCO3 ![]() Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
A. 制备氨气
制备氨气
B.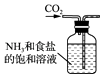 制取NaHCO3
制取NaHCO3
C. 分离NaHCO3
分离NaHCO3
D. 灼烧NaHCO3
灼烧NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关计算的分析正确的是
A. 某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol
B. 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧,则a、b的关系是a=4b+c
C. 反应KClO4+8HCl===KCl+4Cl2↑+4H2O中,每生成4 mol Cl2转移的电子数为8NA
D. 磁性氧化铁与过量稀硝酸反应的化学方程式为:Fe3O4+HNO3(稀) ![]() Fe(NO3)3+NO↑+H2O(未配平)23.2 g磁性氧化铁完全溶解于稀硝酸中,转移0.1 mol电子
Fe(NO3)3+NO↑+H2O(未配平)23.2 g磁性氧化铁完全溶解于稀硝酸中,转移0.1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
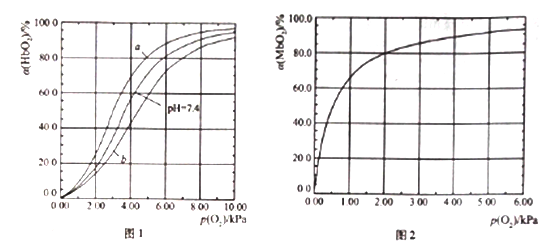
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) ![]() HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) ![]() MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=![]() ,计算37℃时K=____________。
,计算37℃时K=____________。
(6) Mb与氧气结合达平衡时结合度a=____________ [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com