
| 儿童牙膏 | 防臭牙膏 | 透明牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 氧化硅 |
| 物质类别 | 碱 | 盐 | 氧化物 |
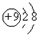 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.分析 (1)根据酸是指在电离时产生的阳离子全部是氢离子的化合物;碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;盐是由金属离子(或铵根离子)和酸根离子组成的化合物;氧化物是指有两种元素组成且一种是氧元素的化合物;
(2)氟原子是9号元素,原子最外层 电子数为7;氟化钠是强碱弱酸盐溶液中完全电离;
(3)“84”消毒液和洁厕灵混合时是次氯酸钠和盐酸发生氧化还原反应生成有毒气体氯气;
(4)漂白粉中的有效成分为次氯酸钙,和空气中二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸具有漂白性.
解答 解:(1)氢氧化铝是由铝离子和氢氧根离子组成的化合物,属于碱;碳酸钙是由钙离子和碳酸根离子组成的化合物,属于盐;二氧化硅是由两种元素组成的且有一种是氧元素的化合物,属于氧化物,
故答案为:碱;盐;氧化物;
(2)氟原子是9号元素,原子最外层 电子数为7,原子结构示意图为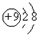 ;氟化钠是强碱弱酸盐溶液中完全电离,电离的方程式为:NaF=Na++F-,
;氟化钠是强碱弱酸盐溶液中完全电离,电离的方程式为:NaF=Na++F-,
故答案为: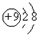 ;NaF=Na++F-;
;NaF=Na++F-;
(3)“84”消毒液和洁厕灵混合时是次氯酸钠和盐酸发生氧化还原反应生成有毒气体氯气,反应的化学方程式为:NaClO+2HCl=NaCl+Cl2↑+H2O,
故答案为:NaClO+2HCl=NaCl+Cl2↑+H2O;
(4)漂白粉中的有效成分为次氯酸钙,和空气中二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸具有漂白性,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
点评 本题考查了物质性质的理解应用,主要是化学方程式书写和产物判断,掌握基础是关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于50% | B. | 等于50% | C. | 小于50% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | B. | A、B、C、D四者共存 | ||
| C. | 消耗A的速率与生成A的速率相等 | D. | D、C的生成速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的燃烧热为1256 kJ/mol | |
| B. | 若转移10 mol电子,则消耗2.5 mol O2 | |
| C. | 若生成2 mol 液态水,则△H=-1256 kJ/mol | |
| D. | 若形成4 mol碳氧共用电子对,则放出的热量为1256 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | B |
| ①能使含溴的四氯化碳溶液褪色; ②比例模型为: 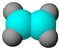 ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为:  |
 .
. +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$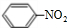 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
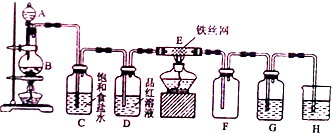
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com