
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
分析 (1)①根据反应能否自发进行的判据:△H-T△S<0,反应自发进行,代入数据来计算;
②k=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;
(2)①互为逆反应的化学反应平衡常数互为倒数;
②根据浓度熵和平衡常数之间的关系来判断反应的状态;
③恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;催化剂对反应热不影响;
(3)①已知平衡时c(H2)=1.6mol,所以c(CO2)=1.6mol,根据公式求出v(CO2)
②CO(g)+H2O(g)?CO2(g)+H2(g)
起始(c) 2 1 0 0
变化 0.8 0.8 0.8 0.8
平衡 1.2 0.2 0.8 0.8,k1=$\frac{0.8×0.8}{1.2×0.2}$=2.7,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(c) 1 0.5 0 0
变化 0.2 0.2 0.2 0.2
平衡 0.8 0.3 0.2 0.2,k2=$\frac{0.2×0.2}{0.8×0.3}$=0.17,故K1 的平衡常数大于K2;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应.
解答 解:(1)①△H-T△S=131.3KJ/mol-T×133.7×0.001KJ/(K•mol),在低温下,该值一定是大于0的,所以不能在低温下自发进行,
故答案为:不能;
②k=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,
故答案为:k=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;
(2)①反应2NH3(g)?N2 (g)+3H2(g)和反应N2 (g)+3H2(g)?2NH3(g)是互为可逆反应,平衡常数互为倒数,故此反应的平衡常数是2,
故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为4mol/L、2mol/L、4mol/L时,Qc=$\frac{{4}^{2}}{4×{2}^{3}}$=0.5=K1,所以该状态是平衡状态,正逆反应速率相等,
故答案为:=;
③恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;加入催化剂,只改变反应的活化能,但反应热不变;
故答案为:向左;不改变;
(3)①已知平衡时c(H2)=1.6mol,所以c(CO2)=1.6mol,v(CO2)=$\frac{\frac{1.6mol}{2L}}{5min}$=0.16mol/(L•min),
故答案为:0.16mol/(L•min);
②CO(g)+H2O(g)?CO2(g)+H2(g)
起始(c) 2 1 0 0
变化 0.8 0.8 0.8 0.8
平衡 1.2 0.2 0.8 0.8,k1=$\frac{0.8×0.8}{1.2×0.2}$=2.7,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(c) 1 0.5 0 0
变化 0.2 0.2 0.2 0.2
平衡 0.8 0.3 0.2 0.2,k2=$\frac{0.2×0.2}{0.8×0.3}$=0.17,故K1 的平衡常数大于K2,
故答案为:大于;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应,
故答案为:放;
点评 本题考查学生有关化学平衡的有关知识,主要涉及反应能否自发进行,平衡常数的计算及表示方法,平衡移动等,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热为____________,表示其中和热的热化学方程式为________________ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:填空题
根据下列化合物:①NaCl、②NaOH、③HCl、④NH4Cl、⑤CH3COONa、⑥CH3COOH、⑦NH3·H2O、⑧H2O。回答下列问题。
(1)NH4Cl溶液显________性,用离子方程式表示原因______________,其溶液中离子浓度大小顺序为________________
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=__________mol/L,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=__________mol/L。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是______(填字母序号)。
A.向水中加入NaHSO4固体 B.向水中加Na2CO3固体
C.加热至100℃ D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH和⑦NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)除④⑦⑧外,若其余5种溶液的物质的量浓度相同,则这5种溶液按pH由大到小的顺序为:_________________(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,7 | B. | 2,8 | C. | 3,7 | D. | 3,8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
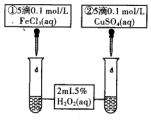 取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.
取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响.| 序号 | 条件 | |
| 温度/℃ | 催化剂 | |
| 1 | 40 | FeCl3溶液 |
| 2 | 20 | FeCl3溶液 |
| 3 | 20 | MnO2 |
| 4 | 20 | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com