
下列说法不正确的是( )
A.化学反应过程中,一定有化学键的断裂和形成
B.盖斯定律实质上是能量守恒定律的体现
C.反应前后原子种类和数目不变遵循的是质量守恒定律
D.如果某化学反应的?H和?S均小于0,则反应一定能自发进行
D
【解析】
试题分析:A.化学变化的过程就是原子重新组合的过程。在这个过程中,反应物的化学键要断裂,生成物中的化学键要生成。因此在化学反应过程中,一定有化学键的断裂和形成。正确。B.盖斯定律表明在化学反应的过程中放出或吸收的能量的多少与反应途径无关,而与发生反应的物质的开始的状态与生成物的状态有关。它从实质上是能量守恒定律的体现。正确。C.化学反应的过程就是原子重新组合的过程。在这个过程中,原子种类和数目不变,所以参加反应的各种物质的质量与反应后生成的各种物质的质量相等。即遵循质量守恒定律。正确。D.如果某化学反应的?H和小于0,?S大于0,即?G=?H-T·?S<0,则反应一定能自发进行。错误。
考点:考查质量守恒定律、盖斯定律、反应的自发性及化学反应与化学键的关系的知识。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2015届四川省成都市2012级临诊考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能大量共存的是
A.c(Fe3+) =0.1mol·L-1的溶液中:K+、NH4+、SCN-、SO42-
B.水电离出的(OH-)=1。0×10-3 mol·L-1的溶液:Na+ 、K+、MnO4-、C2O42-
C.能与铝反应生成氢气的溶液中:K+、Cl- 、Na+、SiO32-
D.0 1 mol·L-1NaOH溶液K+、Na+、SiO32-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:填空题
已知A(g)+B(g) 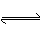 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时 c(A)= mol·L-1, C的物质的量= mol;
若经一段时间后,反应达到平衡,则此时A的转化率= ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 ( 填“变大”或“变小”或“不变”);
(3)判断该反应达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)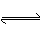 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
②Fe2O3(s)+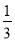 CO(g)=
CO(g)= 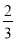 Fe3O4(s)+
Fe3O4(s)+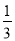 CO2(g) ΔH=-15.73kJ·mol-1
CO2(g) ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ·mol-1
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218kJ·mol-1 B.-109kJ·mol-1
C.+218kJ·mol-1 D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市元宝山区高二上学期期末化学试卷(解析版) 题型:选择题
已知热化学方程式:SO2(g)+ 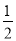 O2(g)
O2(g)  SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A.196.64kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(16分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3- 、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是
和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。
A.Br- B.SO C.CH3COO- D.HCO
C.CH3COO- D.HCO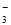
②A中阴、阳离子个数比为
③B的水溶液中所有离子的浓度由大到小的顺序为
(用离子符号表示)。
④将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1 g)。
(3)将Cu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的 (填离子符号),有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A.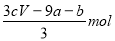 B.(a+3b)mol C.
B.(a+3b)mol C.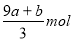 D.(cV-3a-9b)mol
D.(cV-3a-9b)mol
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:填空题
【化学选修3:物质结构与性质】(15分)
(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图。
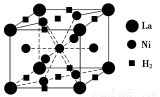
①Ni在元素周期表中的位置是 ,其基态原子的外围电子排布式 是 。
②该合金储氢后,含1 mol La的合金可吸收H2的物质的量为 。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②BH—4的空间构型是 (用文字描述)。
(3)液氨是富氢物质,是氢能的理想载体,利用N2+3H2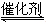 2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
2NH3实现储氢和输氢。下列说法正确的是 (多项选择)。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN—的电子式为: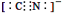
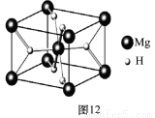
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图12所示,已知该晶体的密度ag·cm-3,则晶胞的体积为 cm3〔用含a、NA的代数式表示(NA表示阿伏伽德罗常数)〕。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
100 mL 6 mol·L-1的H2SO4溶液与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4固体C.NaOH溶液 C.K2SO4溶液D.CuSO4固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com