
分析 热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,据此解答①②③,
④首先写出乙醇和乙烯燃烧热的热化学方程式,再利用盖斯定律解答;
⑤由盖斯定律Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得,由此分析解答.
解答 解:①1mol氮气完全反应,能生成2mol氨气,放热92.2KJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1;
②中和热为57.3KJ/mol,据此书写为H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,故答案为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1;
③燃烧热是1mol氢气燃烧放出的热量,2g氢气为1mol,其燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ•mol-1;
④燃烧热是指1mol可燃物完全燃烧生成稳定化合物时放出的热量,所以乙醇和乙烯燃烧的热化学方程式为:
(1)C2H5OH(l)+2O2(g)=2CO2(g)+3H2O(l)△H=-1366KJ/mol,(2)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411.0KJ/mol
据盖斯定律(2)-(1)得:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2 kJ•mol-1,
故答案为:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2 kJ•mol-1.
⑤Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol.
点评 本题考查反应热的计算、热化学方程式的书写,题目难度不大,注意盖斯定律的应用,学生在书写热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
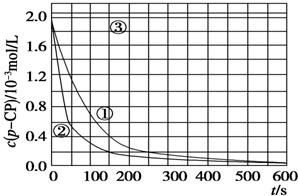 [数据处理]
[数据处理]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
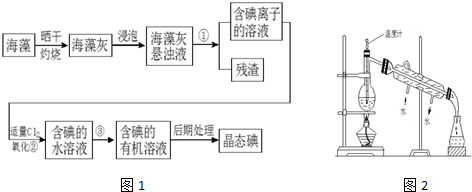
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
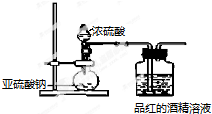
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
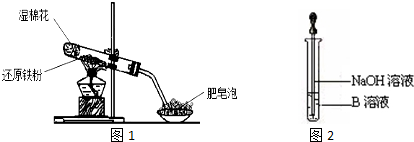
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| A | Cl2 | SO2 | Ba(NO3)2 |
| B | HCl | CO2 | 石灰水 |
| C | NH3 | SO2 | Ba(OH)2 |
| D | NO2 | SO2 | BaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应类型取代反应
,反应类型取代反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com