
| A. | 8.15 | B. | 9.3 | C. | 10.15 | D. | 11.6 |
分析 Mn2+沉淀较为完全[c(Mn2+)<1×10-5mol/L],根据Ksp求出OH-离子的浓度,再根据Kw求出氢离子的浓度,然后求pH,以此解答该题.
解答 解:Mn2+沉淀较为完全时的浓度为1×10-5mol/L,已知Ksp=c(Mn2+)×c2(OH-),
则c(OH-)=$\sqrt{\frac{{K}_{sp}}{c(M{n}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-13}}{1×1{0}^{-5}}}$mol/L=$\sqrt{2}$×10-4mol/L,
则c(H+)=$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{\sqrt{2}×1{0}^{-4}}$mol/L=$\frac{\sqrt{2}}{2}$×10-10mol/L,
所以pH=-lg$\frac{\sqrt{2}}{2}×1{0}^{-10}$=10+$\frac{1}{2}lg2$=10.15.
故选C.
点评 本题考查溶度积常数及溶液pH的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意掌握难溶物溶度积常数的概念及计算方法,明确Mn2+沉淀较为完全时c(Mn2+)≤1×10-5mol/L为解答关键.


科目:高中化学 来源: 题型:推断题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯可以燃烧 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 苯通常易发生取代反应较难发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
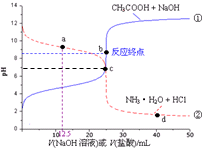
| A. | a点:c(Cl-)>c(NH3•H2O)>c(NH4+) | B. | b点:c(OH-)=c(H+)+c(CH3COOH) | ||
| C. | c点:c(NH4+)=c(CH3COO-) | D. | d点:c(NH4+)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
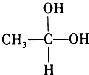 →CH3-CHO+H2O
→CH3-CHO+H2O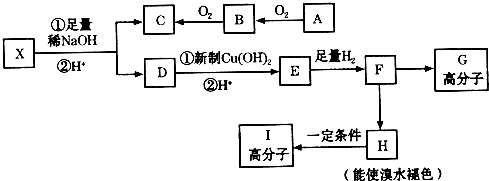
 .
. .
. .
.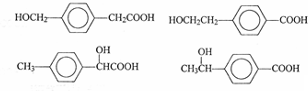 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 | |
| D. | 物质的量浓度为1 mol•L-1的K2SO4溶液中,含2NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
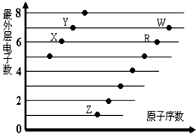
| A. | X与Z两种元素形成的化合物一定是离子化合物,有且只有离子键 | |
| B. | RX2、WX2、Z2X2都能使品红溶液褪色,且褪色原理相同 | |
| C. | R、W所形成的氧化物的水化物的酸性强弱为W>R | |
| D. | X、Y、R、W四种元素形成的气体氢化物中最稳定的是 Y 的气态氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com