
 。
。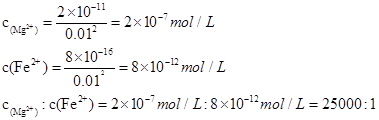


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源:不详 题型:填空题
| O | -3 |
| O | 2-3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学电源有一次电池、可充电电池和燃料电池等,一次电池只能放电,不能充电 |
| B.铅蓄电池应用广泛,主要优点是单位重量的电极材料释放的电能大 |
| C.燃料电池具有能量利用率高、可连续使用和污染轻等优点 |
| D.锂电池是一种高能电池,体积小、重量轻,单位质量能量比高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
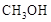 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。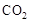 可制取甲醇,其反应为:
可制取甲醇,其反应为: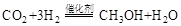

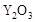 的
的 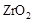 晶体,在高温下它能传导
晶体,在高温下它能传导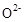 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
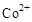 氧化成
氧化成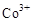 ,然后以
,然后以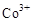 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成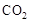 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程: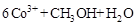
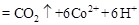 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L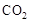 时,共转移电子 mol。
时,共转移电子 mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡到a极 |
| C.电池正极的电极反应式为4H++O2+4e-===2H2O |
| D.电池工作时,1 mol二甲醚被氧化时有6 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该电池负极的电极反应为:Al–3e-=Al3+ |
| B.电池工作时,溶液中铝离子向正极移动 |
| C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 |
| D.当导线中有3.612×1024个电子通过时,电池负极质量减少27 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4.48 L | B.5.6 L | C.6.72 L | D.13.44 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。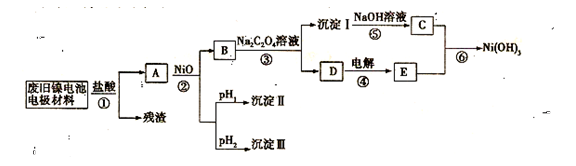
| M(OH)x | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
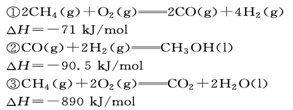
| A.反应不需要加热就能进行 |
B. , , |
C.甲醇的燃烧热为: |
D.若CO的燃烧热 ,则氢气的燃烧热 ,则氢气的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com